人類の希望…9割のがんに効果があるという「光免疫療法」の真価とは
「物理的にがん細胞を壊す」「再発しても免疫細胞がいち早く反応」
出典URL:https://news.yahoo.co.jp/articles/0aba25d2812c1bccfce6f5cd61a1eafdd702beee?page=1
■がんの消滅
2021年の厚生労働省の統計によると、日本人の年間170万人ががんになり、そのうち70万人が治療法がないなどの理由で「がん難民」になると言われている。しかし、医師の小林久隆氏が発見した「光免疫療法」は9割のがんに効くという。いったいなぜなのか、そのメカニズムとは?
『がんの消滅:天才医師が挑む光免疫療法』 (芹澤健介[著]/小林久隆[医療監修]、新潮新書)より、一部抜粋、再構成してお届けする。
■なぜ「9割のがんをカバーする」ことが可能なのか
なぜ光免疫療法は「9割のがんをカバーする」ことが可能になるのか、その答えがこの抗体にあるからだ。
「光免疫療法は理論的に、それぞれのがん抗原に適合する抗体があれば必ず効果が出る治療法です。最初に認可された薬の抗体はセツキシマブで、EGFRをターゲットにしています。でもIR700と結合する抗体を変えてやれば、別のがん細胞を狙うことができます。がん治療の分子標的薬としてFDA(米食品医薬品局)に認可されている抗体はすでに35種類以上あります。認可されていないものも含めれば、それこそ星の数ほどある」(米国国立衛生研究所・小林久隆主任研究員)
これら抗体は分子標的薬として使う場合、がん細胞の働きを抑える役割を担うためには、ほぼすべてのターゲットにフタをしなければならないので大量に投与する必要がある。
だが光免疫療法で使う場合はIR700が直接的に攻撃するため、使用量も圧倒的に少なくてすむという。使用量が少なければ、当然、医療費も安価ですむ。
「使用量は分子標的薬として使う時の約10分の1以下まで抑えることができます。もともと抗体の副作用というのは少ないのですが、量が少なければ副作用もさらに抑えられます」
2023年現在、光免疫療法はアキャルックスと名づけられたIR700とセツキシマブの複合体を使って一部の頭頸部がんに対応しているが、それはEGFRが最もポピュラーながん抗原だからだ。
全がんの2割強に発現するEGFRは、乳がんのおよそ2割を占め、特に悪性度が高い「トリプルネガティブ」というタイプでも多く発現している。
「IR700と、例えばトラスツズマブを結合すれば、HER2陽性型の乳がんや大腸がんなどにも対応できるようになるわけです」
光免疫療法の特徴は、この拡張性の高さなのだ。
実際、すでにマウス実験ではこのIR700+トラスツズマブの複合体がHER2陽性型の乳がんに効果的であるという。
「僕が光免疫療法が8割、9割の大部分のがん種に対応できるはずだと考えている論拠はここにあります。ほとんどのがん細胞には目印となる特異ながん抗原があって、対応する抗体もすでに見つかっています。たとえば胆管がんなら多くにCEAという抗原が過剰発現していますから、IR700とCEA抗体を合成してやれば胆管がんにも効くはずです」
ほとんどのがん抗原に対応する抗体がすでに市販化されていることが重要だと小林は言う。
「まずはそこにあるものを使いましょう、ということです。市販されている抗体を使った方が開発スピードも間違いなく速い。それに安い。そう考えるのが自然です。やっつけたいがん細胞の抗原に合致する抗体があれば、あとはIR700とくっつけてやればいい。そうすれば光免疫療法は作用するはずですから」
光免疫療法が「発見」される前、2009年5月に小林らは、4種類のがんを同時に光らせるマウス実験を成功させている。この実験結果は、IR700とさまざまな抗体を合成してやれば、それぞれのがん種にIR700を届けてやれることを示している。
「肺がん、乳がん、大腸がん、甲状腺がんを同時に発症させたマウスを準備して、それぞれのがん抗原に対応する別々の抗体と色素を結合させてマウスに注射しました。そうすると、狙った通り、それぞれのがん細胞が別々の色に光って、がんの種類を色で仕分けることができました」
2020年2月には名古屋大学の研究グループが、小細胞肺がんに特異的に発現するDLL3という抗原に対応する抗体とIR700を合成、細胞実験でがんを消すことに成功している。
「抗体医薬は今後も大いに発展していく分野だと思います」と小林は言う。
「実際、世界中の製薬会社がこぞって新しい抗体の開発に力をいれています。現在、アキャルックスにはセツキシマブを使っていますが、近い将来、さらにいい次世代型の抗体が開発される可能性もある。その時は新しい抗体と取り替えて新薬を設計してやればいい。光免疫療法はそういう設計の変更も容易です」
■光免疫療法の真価
先に光免疫療法のメカニズムは「実にシンプルである」と書いた。「がん細胞だけを狙い、物理的に、『壊す』のだ。がん細胞と特異的に結合したIR700が、近赤外線を当てられると化学反応を起こし、がん細胞を破壊する。これだけだ」と。
今ではこのロジックがご理解いただけるはずだ。
だが、確かにメカニズムは「これだけ」なのだが、実は光免疫療法の効果は「これだけ」ではない。続きがある。
光免疫療法は、狙ったがん細胞を物理的に破壊すると同時に、がんに対する免疫力を上げる、いわば「二階建て」の治療法なのだ。小林は言う。
「がん細胞が壊れるまでが光免疫療法の前段階の働きですね。ここから先は患者さんの免疫の働きで、がん細胞が死んだという情報が免疫システムに伝わると、周辺の免疫細胞が活性化して、がんに対してさらなる攻撃を始めるのです」
これまでの三大療法、外科手術や放射線治療や化学療法はがん細胞を減らすことはできたが免疫細胞を増やすどころか減らすことしかできなかった。
「第四の治療法」であるがん免疫療法は免疫は活性化できても、直接がん細胞を減らせるわけではなかった。ところが光免疫療法ではがん細胞を減らし、免疫を活性化する。これが光免疫療法の真価だと言ってもいいかもしれない。
「従来の方法は、いわば矛と盾のどちらかしかなかったわけです。そうした意味で、矛と盾を両方備えた光免疫療法は、まったく別種の治療法なのだということが伝わるといいなと思っています。がんの治療というのは、ある意味、戦争と同じかもしれません。敵であるがん細胞を減らして、味方である免疫細胞を増やしてやればいい。でも、そんな簡単なことが、今までの治療法ではできなかった」
高校生物基礎の復習をしておくと、免疫とは自分の体内から異質なものを排除し、体を一定の状態に保つ機能のことだ。体温なり血糖値なり、体の内部環境をある状態に保とうとする傾向を恒常性とかホメオスタシスと呼ぶが、免疫は免疫細胞をはじめ、体のさまざまな機能を使って病原菌やウイルスといった異物を排除することで恒常性を保とうとする。
例えば異物が体内に侵入してきた時に抗体を産生し、異物を無力化するなどだ。この免疫を司るシステムを免疫系という。では、光免疫療法はなぜ免疫系を活性化することができるのか。
小林は言う。
「IR700と結びついたがん細胞は近赤外線を当てると、ちょうど焼き餅のように膨らんでポンと割れて壊死します。実験の観察を続けるうちに、これは一般的な細胞の死に方ではなく、少し特殊な壊れ方であることがわかってきました。がん細胞を追撃する免疫細胞にとっても非常に望ましい壊れ方だったのです」
■多くのがん細胞は、アポトーシスがうまく機能せず、無限に増え続けてしまう
〝望ましい壊れ方〟とはどういうことか。
「光免疫療法でのがん細胞の壊れ方というのは、細胞膜が破れるだけの極めて単純、物理的な壊れ方です。がん細胞の組織を包み込んでいる薄い膜が破れるだけなので、その内側の構成分子にはいっさい傷はつかないんですね。ここが重要なポイントなんですが、この壊れ方は〈アポトーシス〉ではありませんし、一般的な〈ネクローシス〉に近いが少し様子が違う」
アポトーシスとネクローシスは生物学用語でいずれも細胞死を表す。ただしアポトーシスは〈プログラムされた細胞死〉と言われる細胞本来の寿命による自然死を指し、ネクローシスは〈制御されない細胞死〉と定義される。前者が「自然死」「衰弱死」だとすれば後者は「事故死」「変死」である。
細胞にはあらかじめ決められた寿命がある。
「腸壁の細胞のようにわずか2、3日しか寿命のない細胞もあれば、免疫の記憶に関わるメモリー細胞のように数十年から100年にもわたって生きるものもあります」
細胞の寿命はさまざまだが、すべての多細胞生物は古い細胞と新しい細胞を入れ替える「新陳代謝」を繰り返している。正常細胞はあらかじめプログラムされた通り、一定の時間が経つと自然と死ぬように設計されており、おかげで新陳代謝が進む。
「この細胞の自然死、アポトーシスがうまく機能しないと細胞は無限に増え続けることになります。多くのがん細胞がそうですね。基本的にはアポトーシスを起こしにくく、無限に増殖する。ごく稀にアポトーシスを誘発して死ぬものもありますが、その場合はミイラのようにだんだんと萎んでいくだけです」
〈事故的細胞死〉とも言われるネクローシスは何らかの外的要因で細胞が突然死することだ。
「怪我や外科手術で細胞が割れたり、切れたり、やけどで熱変性をしたり、放射線で中身もろとも焼かれてしまったり、といった細胞の死に方はネクローシスに当たりますが、そうした場合、細胞の中身も何らかの傷を負うことが多い」
光免疫療法のがん細胞の壊れ方もこのネクローシスの一種ではあるが、少々違う。
細胞膜が壊れただけで、核や細胞質といった中身がきれいに残っている。熱変性も起こしていなければ化学物質の影響もない。こうした〈免疫原性細胞死〉がピュアな形で一斉に起こるという特殊な死に方になる。
「大量のがん細胞が短時間に一斉に免疫原性細胞死を起こし、その中身がぶちまけられると、次の瞬間、その周辺にいる免疫細胞たちが壊れたがん細胞の中身をぱくぱくと食べはじめます。さまざまな免疫細胞たちががん細胞の情報を次々に取り込んで一斉に消化・分解していくのです」
これが〝望ましい壊れ方〟なのだ。
■「捕え損ね」のがん細胞を、患者本人の免疫が探し出して倒してくれる
「言い換えれば、いっせいに細胞膜が破けることでがん細胞の全情報が周囲に大量に放出されるんです。無傷で、フレッシュな状態で」
まず情報収集の役割を果たす免疫細胞たちががん細胞の内容物を自身に取り込み、攻撃すべきがんのさまざまな抗原情報を収集する。次にその情報を攻撃する免疫細胞に伝える。
「抗原提示と言うのですが、これで倒すべき異物であるがん細胞の抗原情報が周囲に伝わります。すぐ近くでこんながん細胞が死んだぞ、犯人の仲間がうろうろしているようだ、急いで捕まえろ!という感じで免疫システムが起動するのです」
がん治療の厄介なところは、外科手術なら取り残しがあったり、抗がん剤や放射線でもすべてを倒しきれなかったり、微小ながん細胞が原発組織以外にも飛び散っていたりすることだ。だが光免疫療法で治療した場合、そうした「捕え損ね」のがん細胞を、患者本人の免疫が探し出して倒してくれるというのだ。
この時、壊れたがん細胞の中身が無傷でフレッシュでしかも大量であればあるほど、「指名手配犯」であるがん細胞の〝顔つき〟や身元情報も正確に伝わるのだという。
「それまでは正常細胞との区別があいまいだったがん細胞についても、よりハッキリとコイツが敵だと認識することができ、さらなる波状攻撃を加えることが可能になります。免疫学では〈プライミング〉と呼んでいますが、どのがん細胞を攻撃対象にするのか、攻撃役の免疫細胞に学習させているわけですね。そして、特定のがん細胞が認知されると、そのがん細胞を攻撃するのに適した良質な免疫細胞の数が急激に増えていきます」
そのため免疫原性細胞死であることが重要なのだ。
「細胞がしわしわと萎んで死んでいくだけではダメなんですね」
免疫原性細胞死の利用を試みたがんの治療法は以前からあった。しかし多くの場合、がん細胞の壊れ方がきれいではなく、中身に傷がついてしまったり、熱で変性してしまったりしていた。あるいは、がん細胞だけが死ぬのではなく、周囲の正常細胞や免疫細胞までが死んでしまっていた。この「がん細胞の免疫原性細胞死をきっかけに免疫システムを起動させる」というアプローチを初めて成功させたのが光免疫療法なのだ。
なぜ光免疫療法という名前に「免疫」の2文字が入っているか。 それは、がんに対する患者自身の免疫の力を引き出すからだ。
「まだマウス実験の段階にはなりますが、光免疫療法は同種のがんに対するワクチンの効果があることが確認されています。光免疫療法で治療したがんが再発した場合、免疫細胞がいち早く反応してがん細胞に攻撃を加えることができるのです」
3年以上をかけて作った特殊なマウスモデルを使った実験は次のようなものだ。
「一度植えたがんをまず光免疫療法で治します。そのマウスにもう一度、がんの腫瘍を打ち込むのですね。がん細胞を数百万個の単位で移植するのですが、どれだけ移植してもマウスにはがんが根付かない。がんが再発しないのです」
さらに小林は、この免疫原性細胞死がもたらす以外の免疫活性を高める方法も編み出している。制御性T細胞へのピンポイント攻撃である。
■免疫はがんを殺せるか
制御性T細胞の話に入る前に、私たち一般人が抱いている疑問を解消しておきたい。つまり、人間が本来持つ免疫系が活動するだけで、がんを抑えることはできるものなのかということだ。小林が解説する。
「後天性免疫不全症候群(AIDS)、いわゆるエイズの患者さんが高い割合でがんにかかりやすいというデータがあります」
ヒト免疫不全ウイルス(HIV)に感染した患者の多くが血管性の腫瘍である「カポジ肉腫」やリンパ球ががん化する「悪性リンパ腫」に罹患する。
「免疫不全の人が高い確率でがんになるというのは、逆に考えると、免疫システムが健全に働いている場合、それだけでがんの発生を押さえ込んでいるということです。ですから、がん治療の最適解としては、これまでの三大療法のようにがん細胞を攻撃するだけではなく、体中の免疫を適切に活性化させてやることが必要なんです」
がん細胞は健康な人間であっても一日に5000個ほど発生しているという。がん細胞が生まれる原因のひとつは細胞分裂の際の遺伝子情報のコピーミス。膨大な数のミスが生じているようにも思えるが、人間の体を構成する細胞の数は60兆個とも言われている。60兆のうちの5000個と考えればさほどの割合ではない。
ともあれそうやって発生したがん細胞を日々、退治しているのが私たちの体の免疫機能なのだ。これを「がん免疫監視説」という。1950年代に「近代免疫学の始祖」と言われるフランク・バーネット(1899~1975)が唱えた説だ。
小林は言う。
「がん免疫監視説は理論としては非常に古いものですが、僕も基本的には同じ考えです。防御システムとしての免疫がほどよく活性化してがんを押さえ込める状況になっていれば、たとえ毎日がん細胞が生まれたとしてもなかなか増殖できないはずなんです」
「第四の治療法」である「がん免疫療法」も同じ考えに則っている。
京都大学の本庶佑特別教授と米国テキサス大学のジェームズ・アリソン博士はそれぞれ「オプジーボ」「ヤーボイ」という免疫チェックポイント阻害薬の生成に貢献し、2018年、ノーベル医学・生理学賞を共同で受賞した。選考にあたったスウェーデンのカロリンスカ研究所はこう発表している。
「本庶氏とアリソン氏は、私たちの体に備わった免疫細胞を利用して、あらゆるタイプの腫瘍の治療に応用できる新しい治療法を開発した。がんとの戦いに新しい道を切り開いた画期的な発見である」
ノーベル賞授賞式の晩餐会のスピーチで本庶は次のように語った。 「われわれの発見は始まりにすぎず、がん免疫療法は感染症の治療薬となったペニシリンと同じように医療を根本的に変えるものだ」
オプジーボは日本では2008年に治験がスタート、12年に提出した第Ⅰ相試験結果の論文では、「末期がん患者の20ないし30%に有効」「269名の末期がん患者に実施して、完全寛解、有効例が非小細胞性肺がん、メラノーマ、または腎細胞がんに認められた」と報告された。14年、「悪性黒色腫(メラノーマ)」に適応する治療薬として厚生労働省の承認を受け、翌15年には「切除不能な進行・再発の非小細胞肺がん(NSCLC)」への適応拡大が認められた。現在はこの他、腎細胞がん、頭頸部がん、胃がん、ホジキンリンパ腫などにも保険適用となっている。
だがこの免疫チェックポイント阻害薬も完璧とは言えなかった。
小野薬品工業の公式サイトによれば、肝機能異常や脳機能障害、甲状腺不全に陥る患者も一定数おり、14年から20年1月までの約6年間で127人が死亡したとしている。小林は言う。
「人体というのはとても複雑にできていて、免疫の作用が強ければそれでオーケーという単純なものではないんです。時には免疫が効きすぎて、マイナスに作用してしまうこともあるんですね」
「アレルギー」というのは過剰な免疫反応が原因のひとつだ。「自己免疫疾患」もまた免疫が正常に機能しなくなることで自分の体を自分で攻撃してしまう病気だ。花粉症やアトピー、円形脱毛症も自己免疫疾患が原因となることがあり、例えば円形脱毛症は毛根の細胞が異物と認定されて免疫細胞に攻撃されてしまうことで起こる。
免疫が正常に働かないために引き起こされる病気には「悪性関節リウマチ」や「全身性エリテマトーデス(SLE)」など難病指定されているものもある。
新型コロナウイルス流行の際も話題になった〈サイトカインストーム〉という症状は免疫が暴走することで起こるが、多臓器不全を引き起こして死に到ることもあり、この現象はがん免疫療法として認可されている免疫チェックポイント阻害薬やCAR-T療法でも報告されている。
免疫はがんを殺せる。
だが、自身を傷つけ、殺してしまうこともありうるのだ。
小林久隆(こばやし ひさたか) 1961(昭和36)年生まれ。京都大学大学院医学研究科修了。医学博士。光免疫療法の開発者。米国国立衛生研究所(NIH)主任研究員。
芹澤健介(せりざわ けんすけ) 1973(昭和48)年、沖縄県生まれ。横浜国立大学経済学部卒。ライター、編集者、構成作家、映像ディレクター。著書に『コンビニ外国人』など、共著に『本の時間を届けます』など。
■■光免疫療法の発見とそのメカニズム■■
以下情報はの下記URLからの転記
https://medical-tribune.co.jp/news/2020/0315524631/
■光免疫療法の発見とそのメカニズム
光免疫療法(photo-immuno therapy;PIT)は、光線力学療法(photo-dynamic therapy;PDT)と免疫療法を組み合わせた新たながんの治療法である。2020年現在、局所再発の頭頸部扁平上皮がんを対象とした第Ⅲ相試験が実施中で、臨床応用に期待が高まっている。北海道大学大学院薬学研究院生体分析化学研究室教授の小川美香子氏は、PIT発見の経緯とそのメカニズムについて、第17回日本免疫治療学会(2月22日)で解説した。
■光免疫療法による免疫原性細胞死の誘導
光免疫療法:フタロシアニン投与後に赤外線照射で腫瘍を破壊
PITの発見は2009年にさかのぼる。小川氏が米国立衛生研究所(NIH)主任研究員の小林久隆氏の下で研究を行っていた際、腫瘍細胞の検出を目的に光感受性分子フタロシアニンを用いたイメージングを検討したところ、腫瘍細胞が膨張して破壊され、壊死したことがきっかけという。
フタロシアニンはポルフィリンに類似した安定した構造を持つ化合物である。耐光性が高いため退色が少なく耐久性に優れることから、新幹線の塗料やCDの記録媒体などに利用されている。PITで用いられるのは水溶性の高いシリコン・フタロシアニン誘導体(IR700)で、同氏らは抗上皮成長因子受容体(EGFR)抗体とIR700を結合させた抗体−IR700結合体を作製。腫瘍細胞に結合した抗体−IR700結合体に近赤外光(NIR)を照射すると細胞毒性を示し、結合していなければ毒性を示さないという特徴を有している。マウスを用いた検討では、単回の抗体−IR700結合体の投与・NIR照射により腫瘍細胞の壊死が認められ、反復照射によりさらなる効果が得られ、反復投与と照射を行うことで腫瘍深部の壊死が観察されている(Bioconjug Chem 2012; 23: 604-609)。
2019年の米国臨床腫瘍学会(ASCO 2019)において、複数の前治療歴を有する局所再発頭頸部がん患者30例を対象とした第Ⅱa相臨床試験の結果が報告されており、独立した中央判定における全奏効率は43%(95%CI 5~62.6%)で、完全奏効(CR)は4例(13%)、部分奏効(PR)は9例(30%)であった。無増悪生存期間(PFS)中央値は5.2カ月(95%CI 2.1~5.5カ月)、全生存期間(OS)中央値は9.3カ月(95%CI 5.2~16.9カ月)であった。重篤な有害事象は13例(43.3%)に認められ、うち3例はPITとの関連が示唆されたという。
欧州臨床腫瘍学会(ESMO 2019)では、米国第Ⅰ/Ⅱa相試験の結果、治療効果の有無にかかわらず、一部の症例で免疫活性の潜在的な徴候が見られたことが報告されている。12例中8例に腫瘍細胞および免疫細胞におけるPD-L1発現が認められ、12例の腫瘍細胞でEGFR発現の維持が確認されており、再治療の対象となる可能性が示唆された。また、末梢血の免疫表現型検査の結果、18例中15例において治療後の自然免疫および適応免疫の活性化の可能性が示唆されている。
物理化学的傷害により迅速に細胞を破壊
PITのメカニズムについて、小川氏は「PITの発見は偶然の産物であり、次なる創薬に向けて、細胞傷害メカニズムを解明し、光反応性薬剤の性質を明らかにする必要がある」と強調。さまざまな検討を重ね、PITは4℃の環境下であっても37℃の環境下と同等の抗腫瘍効果を発揮することや、HER2陽性細胞のみを破壊し隣接するHER2陰性細胞に影響を及ぼさなかったことから細胞特異性が明らかとなり、正常細胞への影響が小さい可能性が示されたことを明らかにしている。
また、三次元低コヒーレント定量位相顕微鏡(3D LC-QPM)を用いた検討では、一重項酸素(活性酸素の一種)のクエンチャーであるアジ化ナトリウム(NaN3)を加えても腫瘍細胞の膨張・破壊が観察されたことから、同氏は「PITは『活性酸素による細胞破壊』という従来のPDTとは異なるメカニズムを有することが示唆された」と解説した。
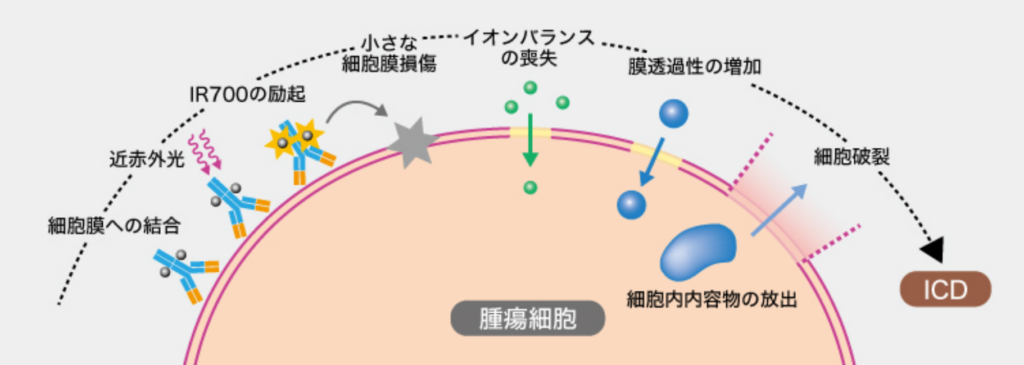
さらに、照射を停止しても細胞の膨張は継続すること、NIR照射直後の細胞膜の損傷は水やイオンのような小分子のみが透過できる微小なサイズであること、細胞内へのNa+の透過後に細胞の破壊が確認されたことなどから、同氏らは「抗体−IR700結合体に対するNIR照射により細胞膜に微小な損傷が生じ、浸透圧やイオン勾配によって細胞内に水が取り込まれ細胞が膨張して壊死に至る」と仮定。放射性標識した水を用いた検討により、細胞内に水が取り込まれ、培養液中の浸透圧を高くすると逆に細胞が縮小することを確認したという。
以上から、同氏はPITのメカニズムについて①腫瘍細胞に結合した抗体−IR700結合体に対するNIR照射により細胞膜が瞬時に傷害②細胞外から水が取り込まれて腫瘍細胞が膨張③細胞膜が破裂して壊死に至るーと解説。なお、細胞膜が瞬時に傷害されるメカニズムについては、「NIR照射によるIR700の化学構造変化により細胞膜表面で不溶性の凝集体を生成し、アクチン繊維の切断を伴う細胞膜傷害が生じる」と説明した。
光免疫療法による免疫原性細胞死の誘導
PITのもう1つの重要な特徴として、小川氏は「免疫原性細胞死(immunogenic cell death;ICD)の効果的な誘導」を提示。PIT後、ICDのマーカーであるcalreticulin、ヒートショックプロテイン(HSP)70、HSP90の発現、抗腫瘍免疫の確立や免疫記憶において重要な役割を果たすアデノシン三リン酸(ATP)、HMGB1の発現、成熟樹状細胞のマーカーであるCD80、CD86、インターロイキン(IL)-12、ヒト白血球抗原(HLA)-DR、CD40の発現が認められているという。
マウスを用いた検討では、ICDを介してがん特異的抗原を貪食した成熟樹状細胞が、ナイーブT細胞への抗原提示により細胞傷害性T細胞(CTL)の分化・増殖を誘導、さらに抗PD-1抗体による全身療法を組み合わせることで、照射部のみならず遠隔の腫瘍においても抗腫瘍活性を示す、いわゆるアブスコパル効果に似た作用をもたらしたことが小林氏らにより報告されている(Cancer Immunol Res 2019; 7: 401-413)。
最後に小川氏はPITについて「PDTと異なり酸素反応カスケードを必要としない物理化学的傷害を起点とするため、迅速に細胞死が引き起こされる。さらに、細胞膜破壊に伴いICDによる細胞死が起こるため、がん免疫が活性化される(図)」とまとめた。
出典:(Cancer Sci 2018; 109: 2889-2896)
■『がんの消滅 天才医師が挑む光免疫療法』芹澤健介[著](新潮社)~[レビュアー]竹内薫(サイエンス作家)~
理論上、がん細胞だけが消え、人体に無害な治療法…ノーベル賞級の発見はどのように生まれたのか? 天才医師の挫折と苦闘に迫る(レビュー)
出典先URL:https://news.yahoo.co.jp/articles/a51582a4dc4e75a945c69261acc3a59e40bbac7c?page=2
iPS細胞の発見でノーベル生理学・医学賞を受賞した山中伸弥先生への取材も面白い。
iPS細胞から免疫細胞を作り、「光免疫療法とiPS細胞の再生医療を組み合わせれば、治療の効果をさらに上げることもできるんじゃないか」と提案する山中先生に対して、
「iPS細胞のがん化を防ぐために光免疫療法を利用することもできるんじゃないか」と返す小林先生。
一流の科学者(医学者)同士の交流が、新たな「化学反応」を生むのではないかと期待が高まる。