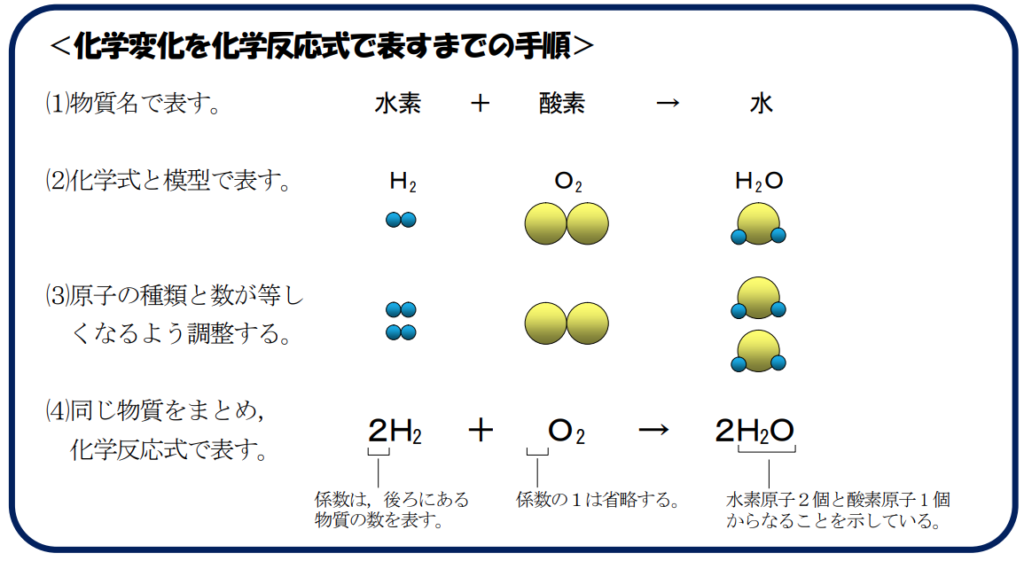
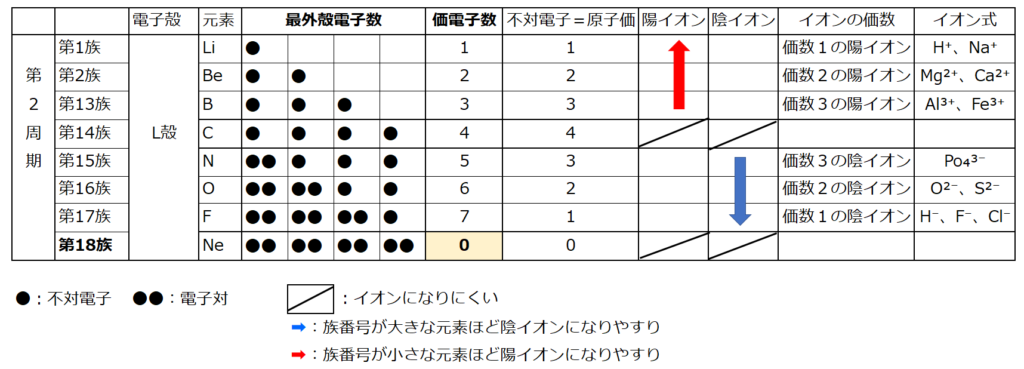
★簡単な化学反応式
【化学反応式】
・炭素を燃焼させると二酸化炭素が出来る。
炭素(C)+酸素(O₂)→二酸化炭素(CO₂)
⇒C+O₂→CO₂
電子のやり取りの観点から眺めると非金属元素同士で結合しているので『共有結合』である。
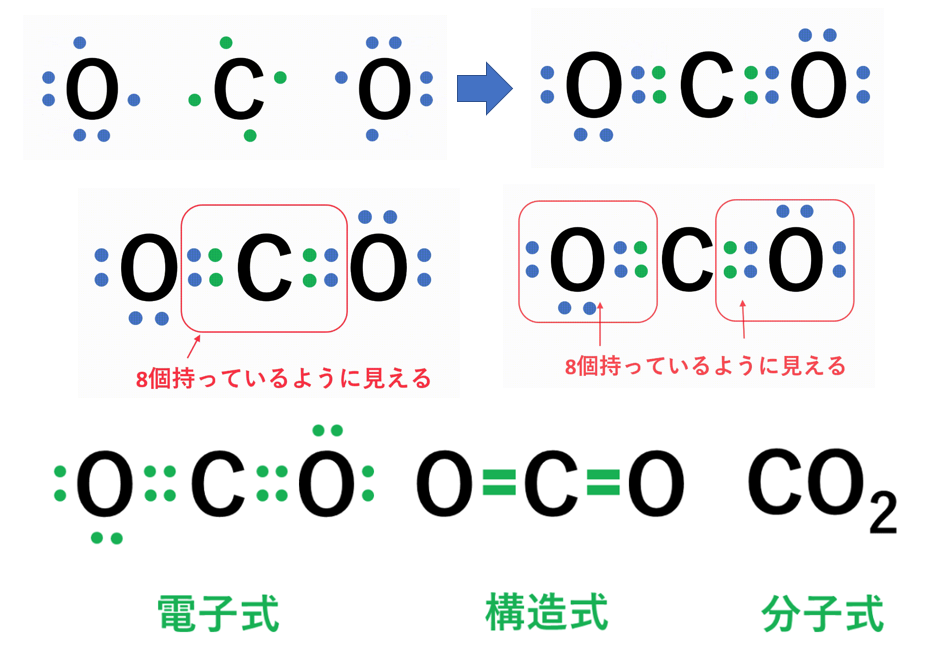

【化学反応式の種類】
①分解、②中和、③酸化、④化合、⑤還元、⑥金属と酸の反応
<化学反応:①分解>
・水を電気分解した化学反応式
水(H₂O)→水素(H₂)+酸素(O₂)
H₂O→H₂+O₂
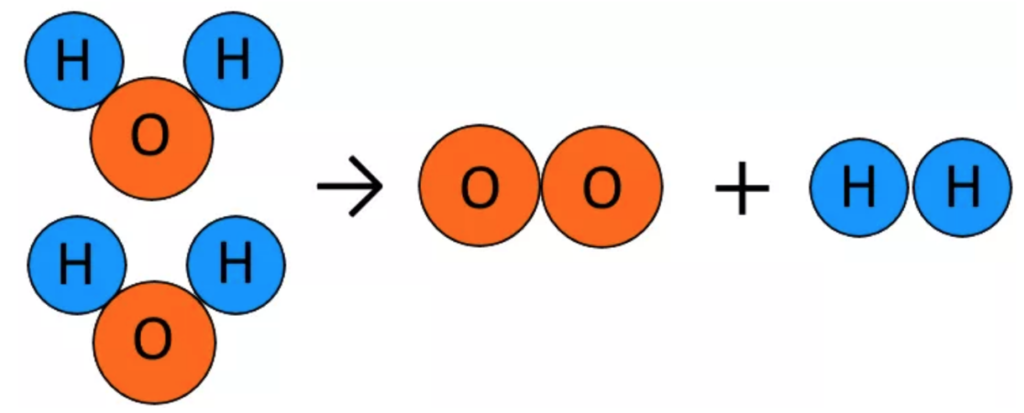
モデル図で表すと

酸素(O)の原子を注目すると、反応前は1個、反応後は2個
左右の原子の数が合っていない
<化学反応式作成手順>
左辺と右辺の原子の数を合わせる。
左辺、右辺の水素(H)の数は同じ。
右辺:酸素(O)の個数が1個。
左辺:酸素(O)の個数が2個。
原子数を合わせる為に左辺H₂Oを2倍にする。
注:反応前の水分子(H₂O)を追加して調整していく。
H₂O→H₂+O₂
↓
2H₂O→H₂+O₂
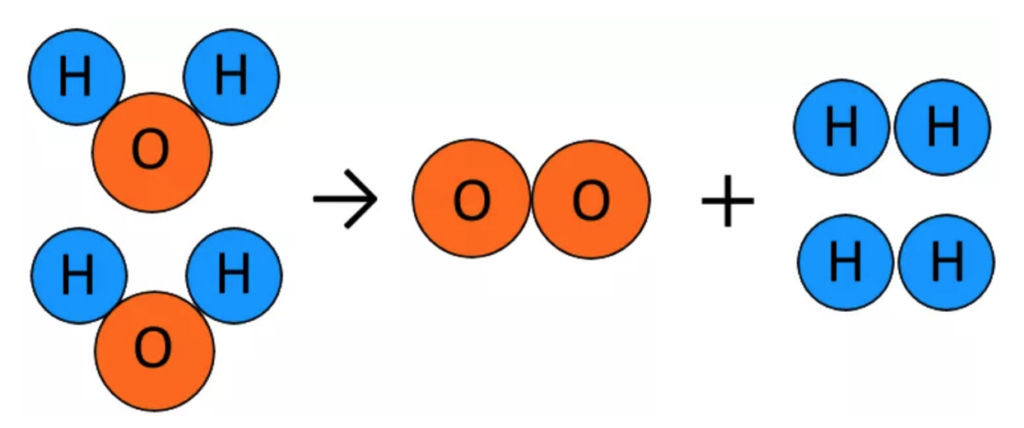
今度は原子Hの数が合わなくなった。
左辺:水素(H)の個数が4個。
右辺:水素(H)の個数が2個。
原子数を合わせる為に右辺Hを2倍にして2H₂にする。
2H₂O→H₂+O₂
↓
2H₂O→2H₂+O₂
反応の前後で原子の数と種類が変わらなく矛盾しなくなった。
<化学反応:②中和>
塩酸(HCl)+水酸化ナトリウム(NaOH)→水(H₂O)+塩化ナトリウム(NaCl)
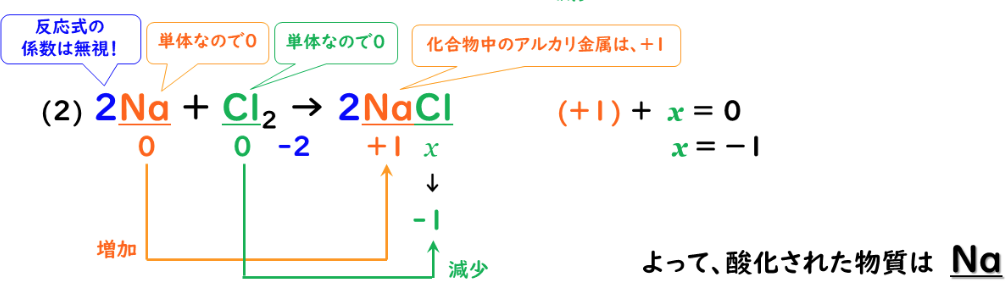
<化学反応:③酸化>
銅の燃焼:2Cu+O₂→2CuO

化学変化の前後で、
ある原子(Cu)の酸化数が増加した時、その原子は「酸化された」という。
<化学反応:④還元>
・酸化銅の炭素を使った還元
酸化銅(2CuO)+炭素(C)→2Cu+CO₂
酸化銅は酸素原子を失い、銅になった。(還元された)
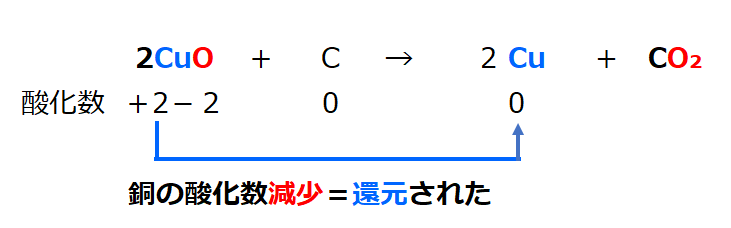
化学変化の前後で、
ある原子(Cu)の酸化数が減少した時、その原子は「還元された」という。
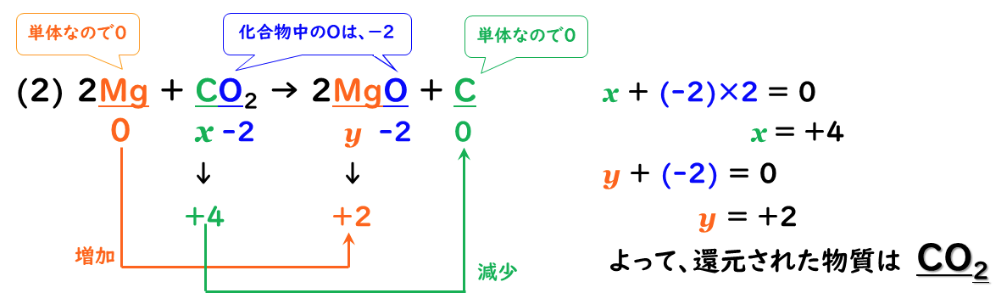
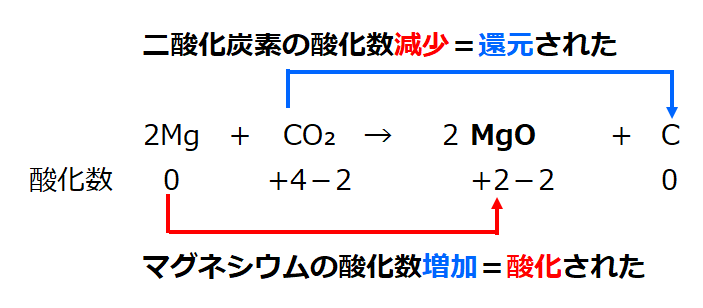

上記のイオン表記を分子表記すると
2Mg + CO₂ → 2MgO + C
・マグネシウム原子(Mg)1個当り、電子を2個(2e⁻)を失って(放出し)マグネシウムイオン(2価の陽イオン)になった。
・二酸化炭素分子(CO₂)1個当り、電子を4個(4e⁻)を得て(受け取って)、炭素が還元された。
<化学反応:⑤化合>
・2 種類以上の物質が結びついて,別の新しい物質ができる化学変化を化合という。化合によってできた物質が化合物である。
⇒物質A+物質B+… 物質C
・鉄(Fe)+硫黄(S)→硫化鉄(FeS)
鉄(鉄粉)と硫黄の粉末を混ぜて加熱すると、激しく反応して硫化鉄ができる。
⇒硫化鉄は鉄や硫黄とはまったく異なる物質であり、黒色で、磁石につかない。
・銅(Cu)+硫黄(S)→硫化銅(CuS)
硫黄の蒸気の中に銅線を入れると,激しく反応して硫化銅ができる。硫化銅は銅や硫黄とはまったく異なる物質であり、黒色でもろく、電気は通さない。
<化学反応:⑥イオン化傾向と電極電位&金属と酸の反応>
・鉄+希塩酸→水素+塩化鉄
Fe+2HCl→H₂+FeCl₂
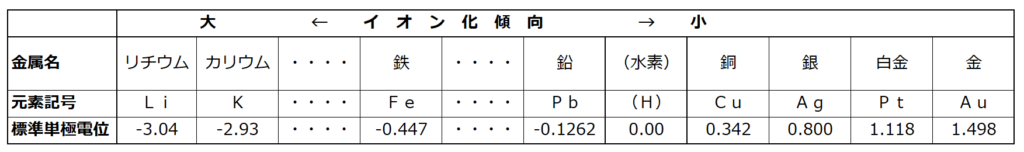
◆金属のイオン化傾向
金属が水又は水溶液中で電子(e⁻)を放出して陽イオンになろうとする性質。
・イオン化傾向が大きいとは?
⇒陽イオンになりやすい→電子を放出しやすい→酸化されやすい。
・イオン化傾向が小さいとは?
⇒陽イオンになりにくい→電子を放出しにくい→酸化されにくい。
・イオン化傾向が小さい金属イオンを含む水溶液にイオン化傾向の大きな金属単体を浸せきすると?
⇒イオン化傾向の大きな金属が酸化され溶解し、イオン化傾向の小さな金属が還元され析出する。
・イオン化傾向
Fe>H
化学反応式
Fe+2HCl→H₂+FeCl₂
鉄(Fe)は水素(H)よりイオン化する傾向が大きいから、希塩酸に浸せきすると、水素イオン(H⁺)によって酸化(電子を失う)されFe²⁺となり溶解する。
一方、水素は鉄によって還元(電子を受け取る)されるため、水素ガス(H₂)を発生する。
●希塩酸(HCL:塩化水素の薄い水溶液)に鉄(Fe)を投入すると、水素(H)が発生し、鉄(Fe)は塩化鉄(FeCl)となって溶解する反応である。
⇒化学反応式は
Fe+2HCl→H₂+FeCl₂
希塩酸であるが、
塩化水素(HCl)は、水素原子(H)と塩素原子(Cl)が共有結合してできている分子であるが、
水に溶けると、
分子が水素イオンと塩化物イオンに分裂して、
HCL → H⁺ + Cl⁻
のように電離する、という特別な性質を持っている。
Fe+2HCl→H₂+FeCl₂をイオンの式に表すと
Fe + 2H⁺ + 2Cl⁻ → H₂ + Fe²⁺ + 2Cl⁻
左辺の「Fe」(金属結合をしている原子)は、右辺では陽イオン(2価の陽イオン)に変わっており、
左辺で陽イオンだった水素は、右辺では原子に変わり、さらに2原子が共有結合して分子となり、(常温常圧で気体の「水素」という物質になって)気体として発生している。
塩素は、左辺でも右辺でも、陰イオン(1価の陰イオン)のままで変化しない。
この反応で「反応した(変化した)」のは鉄と水素であり,塩素は終始イオンのままで変化していない。
式の両辺から、「同じもの(Cl⁻)を消去」すると、
Fe+ 2H⁺ → H₂ + Fe²⁺
これでイオン反応式ができあがる。
■酸化数
化学反応において、原子やイオンの電子の授受(やり取り)を明確にする為に酸化数を用いる。

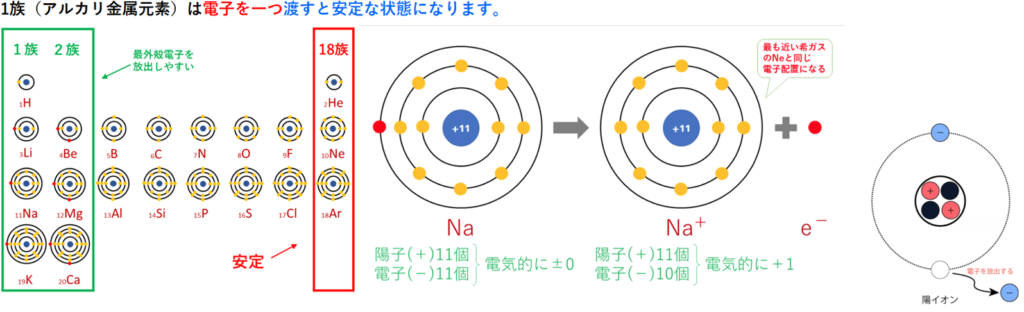
酸化数とは
化合物やイオンを構成している原子が電気的に中性(陽子と電子の数は一致)な原子と比べて
・電子を何個失ったか(どれだけ酸化されたか)状態にあるか
⇒酸化数は+n個

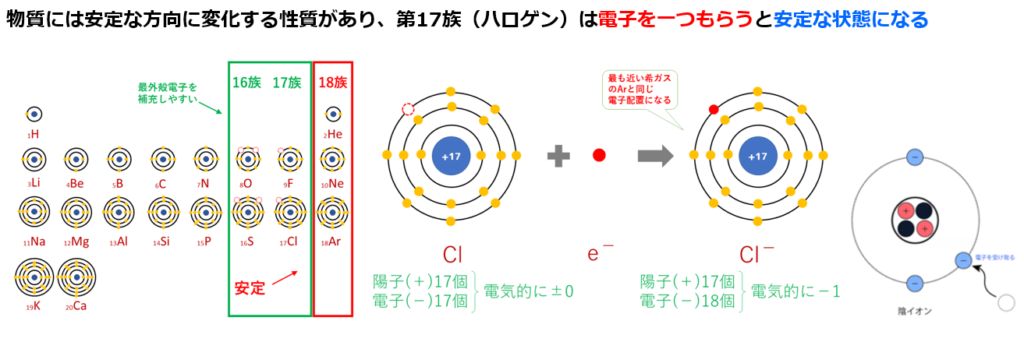
・電子を何個受け取った(どれだけ還元されたか)状態にあるか
⇒酸化数は-n個
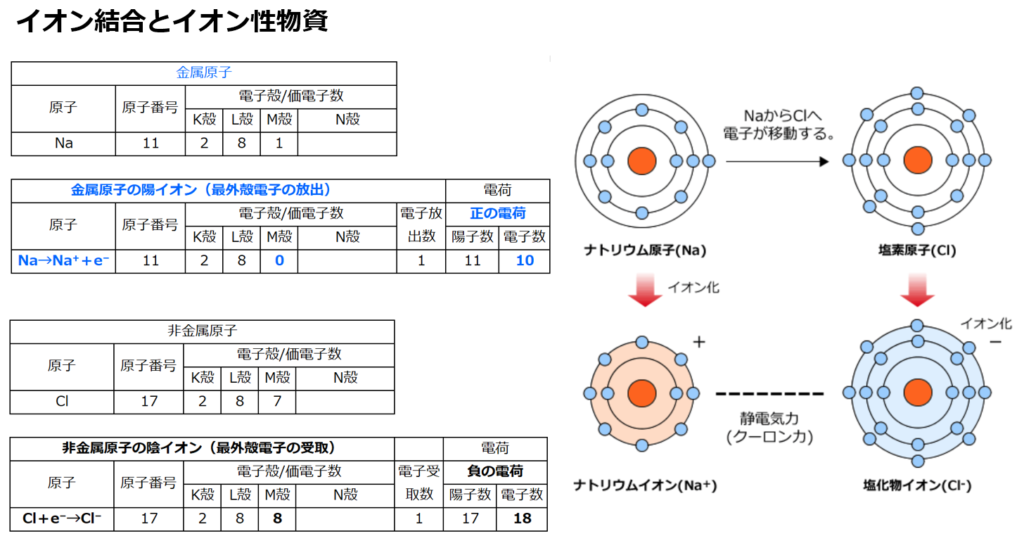

■イオン結合と共有結合の違い
イオン結合は陽イオンと陰イオンがクーロン(静電気力)によって互いに引き合って出来る結合であるから、原子間の電子の受け渡しがハッキリしている。
一方、共有結合で出来てる物質(分子など)は、電子を原子間で共有している為に、電子の受け渡しが曖昧である。
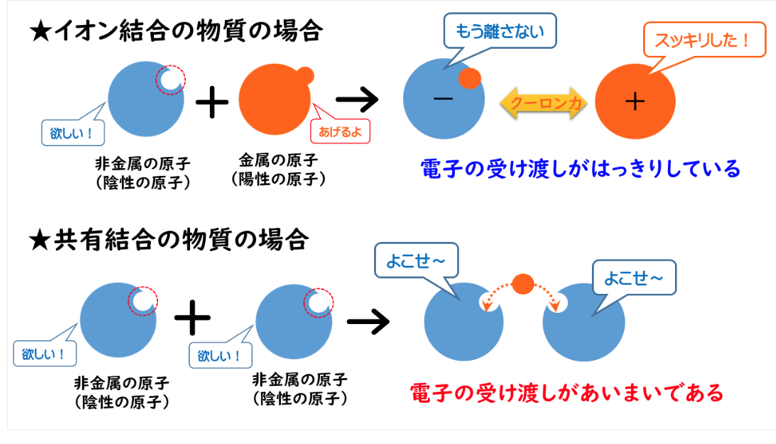
◆イオン結合
・イオン結合は分かり易い。
⇒電子を失えば陽イオンになり、電子を受け取れば陰イオンになる。
イオン結合は陽イオンと陰イオンがクーロン力(静電気力)によってお互いに引き合って出来る結合だから、原子間での電子の受け渡しがはっきりしている。

◆共有結合では
電子を原子間で共有(不対電子を電子対で共有)しているので、
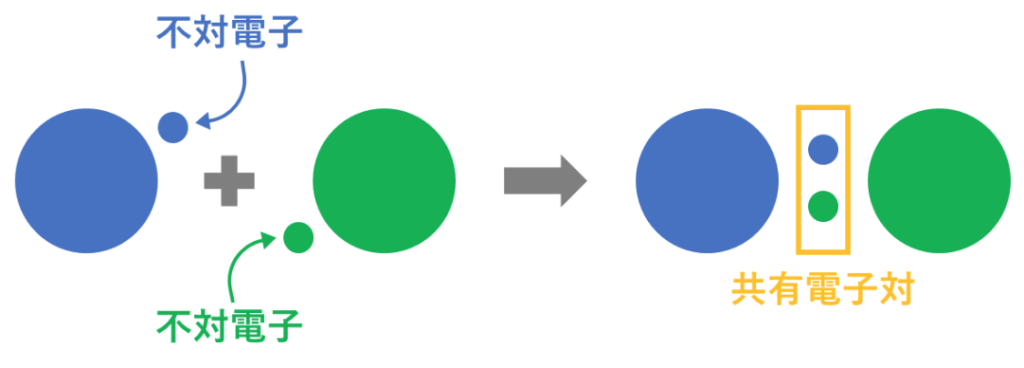
受け渡しが曖昧である。
分子をつくている原子にも
共有電子対を引きつける強さに違いがある(電子陰性度)。
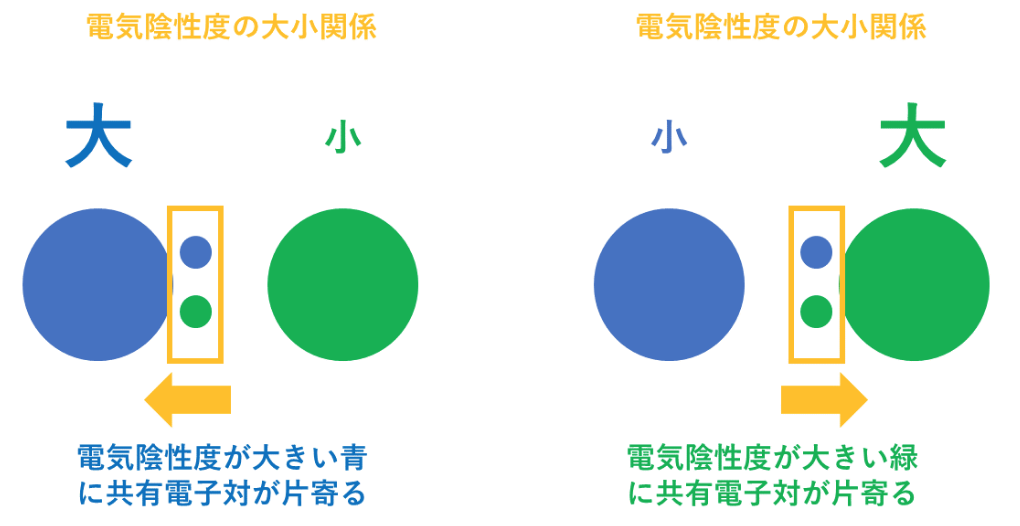
<電気陰性度>
電気陰性度は、分子中の原子がe⁻(電子)を引き付ける強さの事を指す。
言い換えれば、プラスの電気(原子中の陽子)が、マイナスの電気(e⁻(電子))を引き付ける強さと同じである。
従って、同じ周期の元素では(周期表の横行)、右側に行くほど陽子の数が増えるのでプラスの力が強まり、電気陰性度は大きくなる。
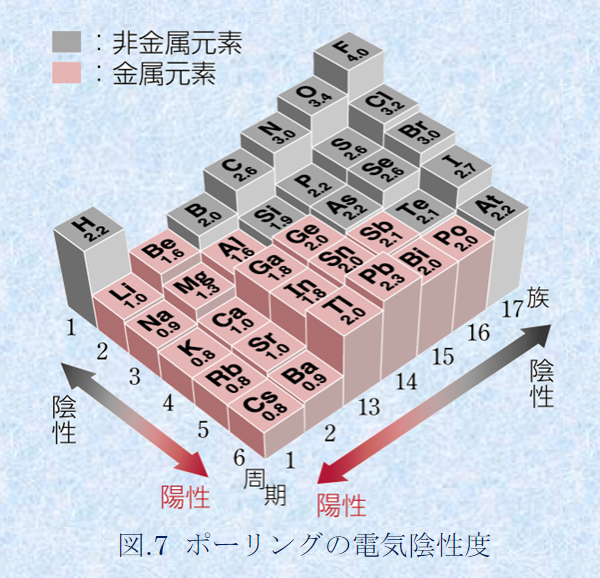
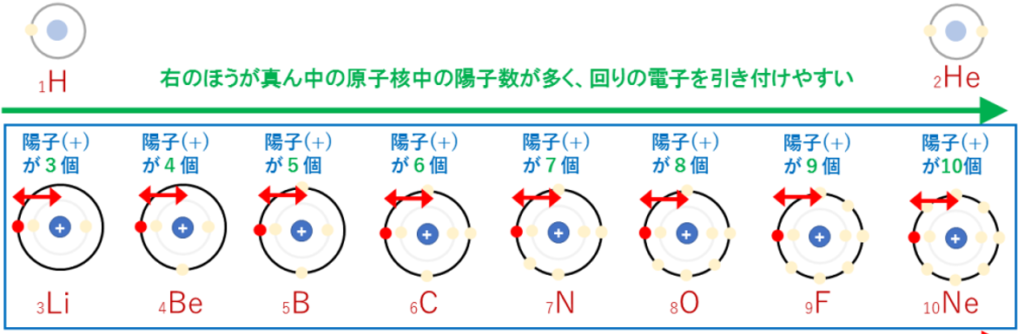
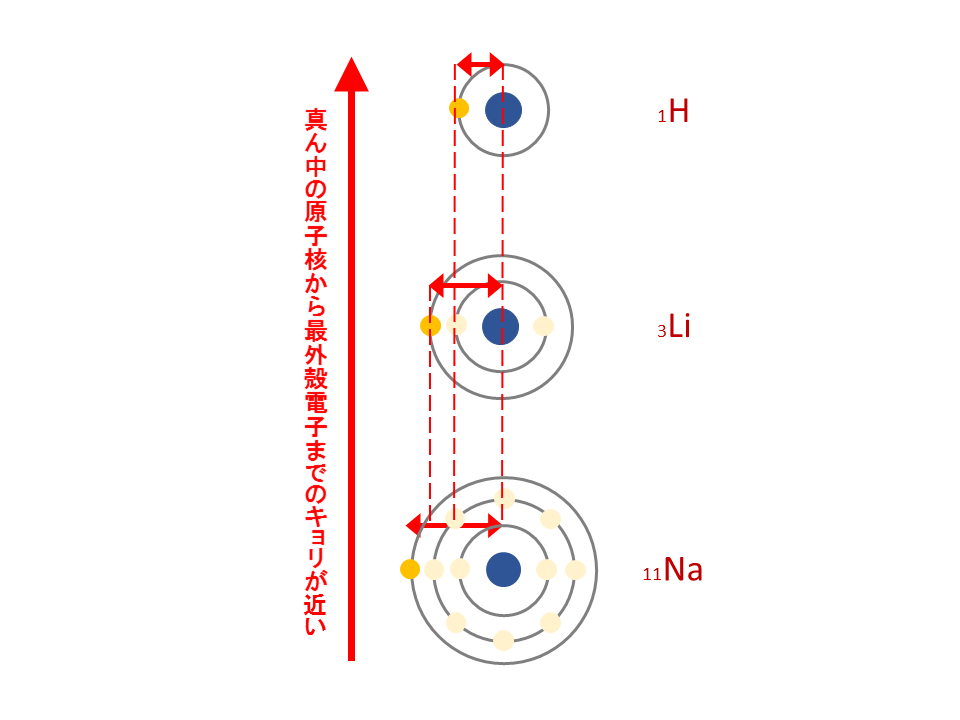
同じ族では(周期表の縦列)、下に行くほど電子の位置が原子から遠くなり、
遠くの電子に対してかかるプラスの力は弱くなるので、電気陰性度は小さくなる。
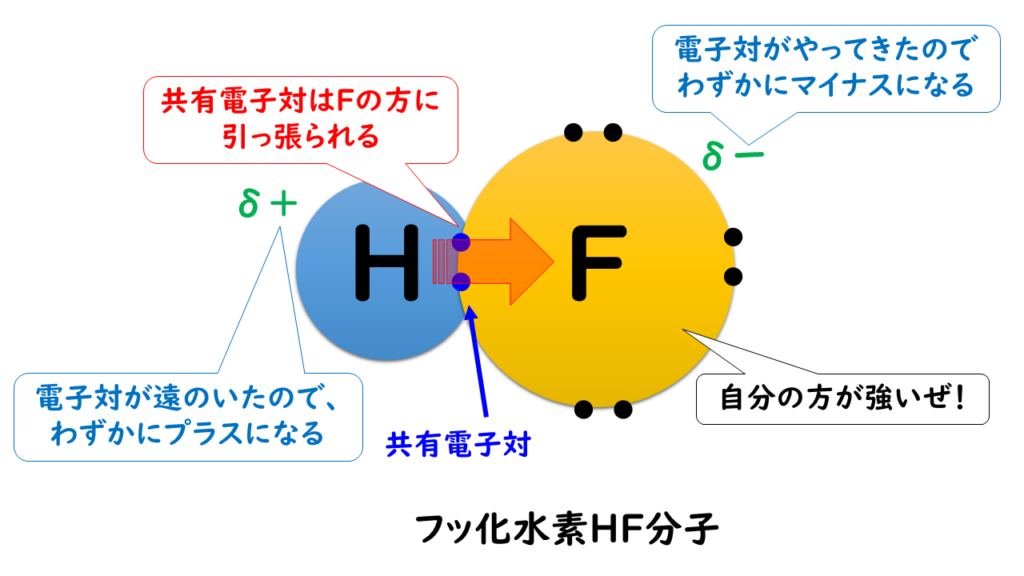
例えば、第1族の水素原子(H:2.2)と第17族のフッ素原子(F:4.0)では、電気陰性度の大きさはH<Fなので、共有電子対はFの方に引き付けられる。


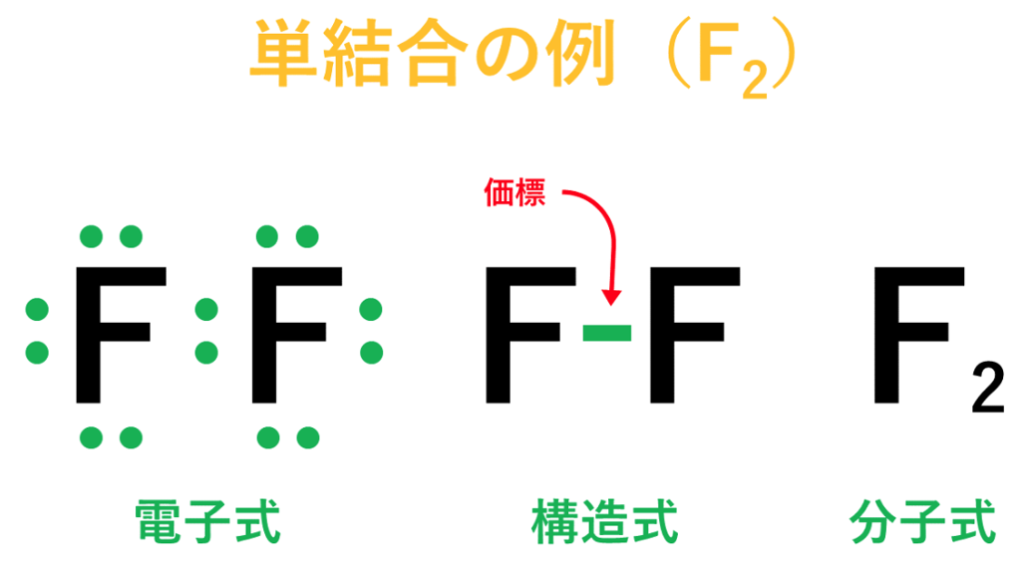
<1種類の原子が2個結びついている分子>
・フッ素(F)の場合は、フッ素原子(F)が2個結びついてフッ素分子(F₂)が出来ている。
・酸素(O)の場合は、酸素原子(O)が2個結びついて酸素分子(O₂)が出来ている。
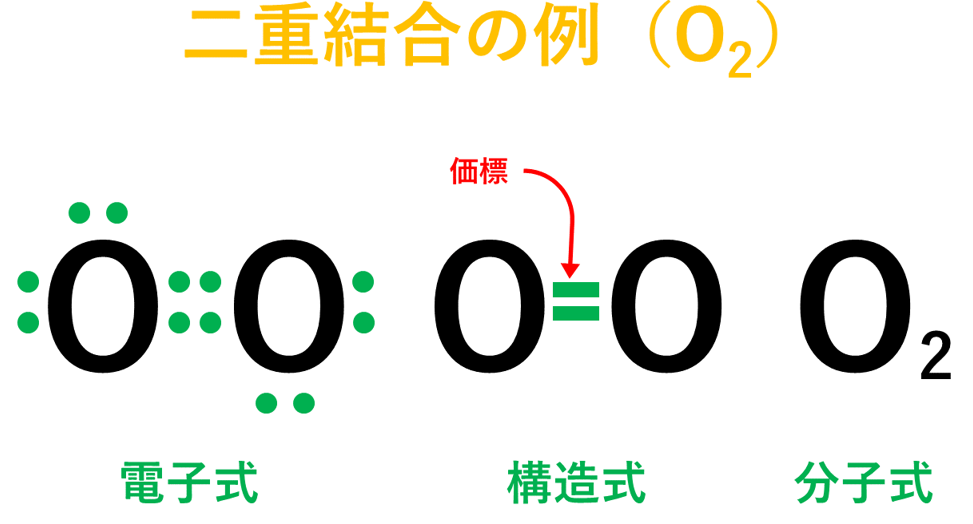
・窒素(N)の場合は、窒素原子(N)が2個結びついて窒素分子(N₂)が出来ている。
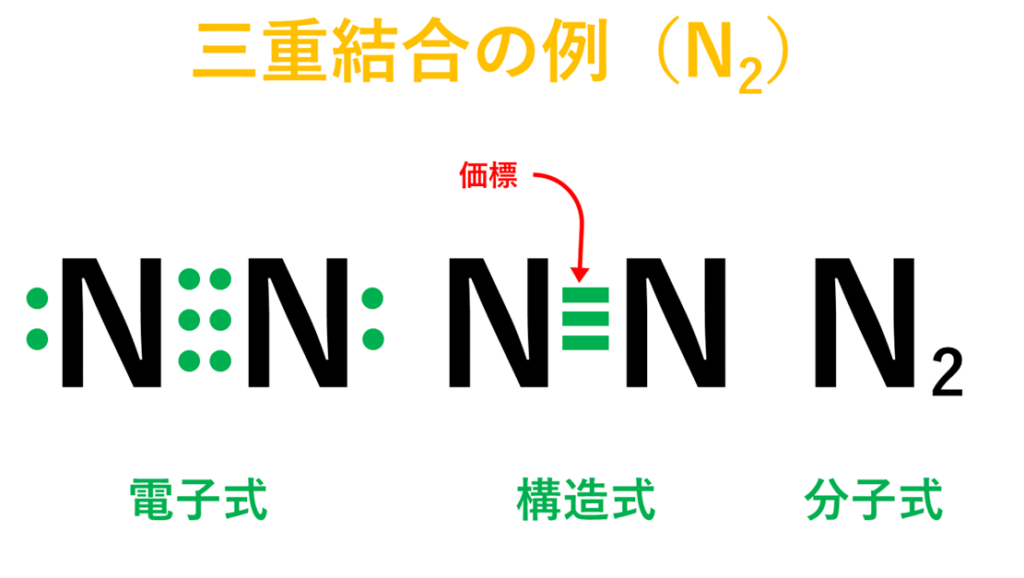
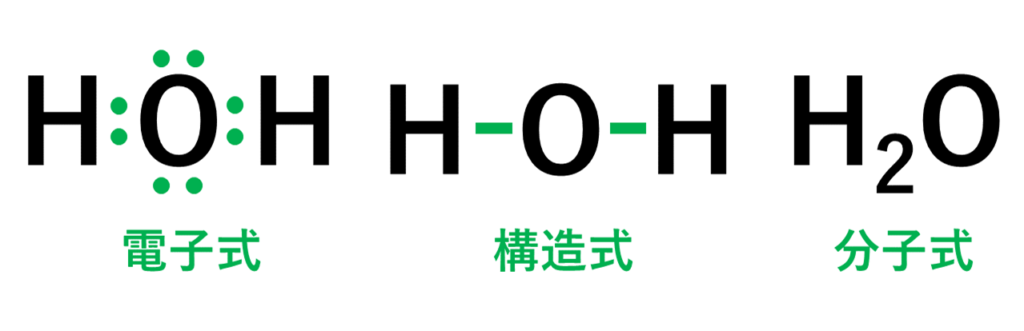
<2種類以上の原子が結びついている分子>
・水(H₂O)の場合は、水素原子(H)2個と酸素原子(O)1個が結びついて、水の分子ができている。
・二酸化炭素(CO₂)の場合は、炭素原子(C)1個と酸素原子(O)2個が結びついて、二酸化炭素の分子ができている。
