─副作用のない固型癌に普遍的な制癌剤は可能だ─(1)
出典:産学官連携ジャーナル https://www.jst.go.jp/tt/journal/journal_contents/2018/04/1804-07_article.html
■癌化学療法の歴史は70年近いが、
その信頼度は低く、
世界保健機関(WHO)、米国NCIとも約90%の制癌剤は失敗という。
EUで2009~13年に承認された44種の制癌剤でも生活の質(QOL)の改善は平均約10%、平均延命率は2.7カ月で喜べない。
国立研究開発法人国立がん研究センターでも高齢者の肺癌患者に対し
化学療法を受けた群と無治療群を比較し
後者の方が延命率は高かったという。
約100年前のノーベル賞で、画期的発見と考えられた光照射療法(PDT)も、また、40~50年前から期待されている硼(ほう)素を用いる熱中性子捕獲療法も癌治療の担い手にはなっていない。
これらの失敗の原因は用いている薬物は、
いずれも低分子で腫瘍部選択性がないためである。
■日本人の2人に1人は癌になる。その傾向は上昇が続いている。
老人人口の割合が増えれば、癌患者の割合は増えるのであるが、
それに伴う重要な問題は二つある。
・一つは多くの制癌剤はあまり効果がなく、毒性が耐え難いほどきついこと、
・二つ目は、最新のものでは1人1年間の薬剤の使用価格が2,000万円以上もするものもある。
肺癌だけでも国費負担は1兆円以上かかるといわれており、
そのような高額医療については、
患者の負担はおおむね免除され、
残りは国家の医療費、健康保険組合、地方自治体などで支払われるので、健保組合も国家財政も破綻につながりかねないといえる。
しかも、そのような薬でも70~80%は全く効かないか、
効いた場合でも思わぬ副作用が待っている。
図1に対数的に増加する制癌剤の患者1人当たりの年間の価格を示す。ここ30~40年で、1,000~10,000倍にもなっている**1。
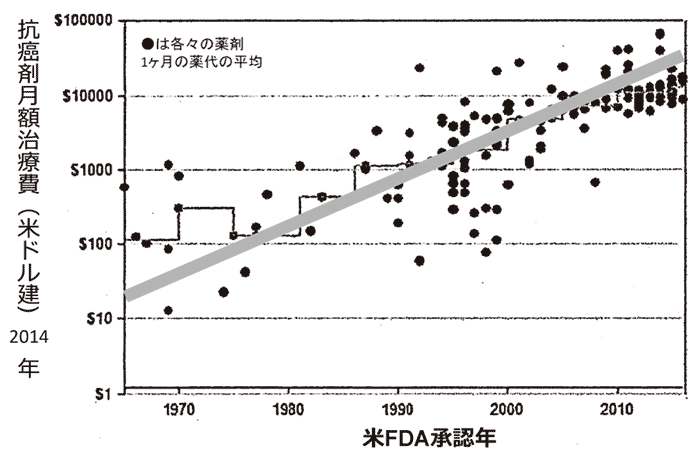
図1 制癌剤の価格の推移
10~20年ごとにほぼ10倍になっている。社会はどこまでこの負担に耐えられるか
制癌剤はなぜ副作用が強いか、なぜ効かないか
もともと制癌剤の出発点は、毒ガス(ナイトロジェンマスタード)の副作用(毒性)の研究であった。
それを白血病薬として開発していったので、それを使うドクターも、毒性があることを百も承知で当然のこととして癌の化学療法は始まっている。
■制癌剤の承認のクライテリアは
延命率の延長が中心であり、表1のようにほんのわずか2~3カ月の延長が大半であり、
また、腫瘍の縮小の評価も50%以上縮小を有効とし、その持続期間はほんの短期間の場合が多い。
さらに、腫瘍マーカー(表1)の低下も評価の中心ではあるが、
患者にとって極めて大切なQOLの改善(表1)の評価などは中心的な課題になっていない。

・もう一歩踏み込んだところでは、
癌の化学療法だけでなく、
光照射療法(光線力学療法、photodynamic therapy、PDT)や
硼素を用いる熱中性子捕獲療法(BNCT、boron neutron capture therapy)も
表2にあるように、PDTは100年以上前に発見された原理でノーベル賞に浴したすばらしい研究であるにもかかわらず、臨床の現場では、ほとんど利用されていない。

これら三つの治療法に共通した根源的な欠陥は、
いずれも低分子化合物の薬物で検討されていることである。
すなわち、一般に低分子化合物は静脈内に投与すると
全身の毛細血管から全身の組織に浸透し(自由拡散で)、
もともと毒性のあるほとんどの制癌剤は
正常な組織に対してもくまなく浸透し、毒漬け状態となり、副作用となる。
・悪いことに、癌細胞も健常細胞も同等に毒漬けになるかというと、
しばしば毒物(制癌剤)の到達(デリバリー)は癌の方が少ないのである。
すなわち、癌組織に栄養を供給している腫瘍の栄養血管(動脈)は、
しばしば、心筋梗塞と同様に、血栓とかフィブリン凝固系の亢進(こうしん)により、
血流がほとんどないか、乏しくなっており、
薬物である制癌剤は健常組織よりも少なめにしか届かないのである。
この問題に対してわれわれは、心筋梗塞と同じ理屈で、
ニトログリセリンなどの血管拡張剤を用いれば、
解決できることを発見し、その展開を現在行っている。
これはすなわち、後述するEPR効果の増強法である。
■EPR効果の増強剤は
ニトログリセリンやACE阻害剤(エナラプリルなど)は安全な薬物で、
容易に制癌剤の腫瘍デリバリーを2~3倍も上げることができる。
─副作用のない固型癌に普遍的な制癌剤は可能だ─(2)
出典:産学官連携ジャーナル https://www.jst.go.jp/tt/journal/journal_contents/2018/05/1805-07_article.html
EPR効果は腫瘍選択的薬物デリバリーの基本原理である
■EPR効果の発見の端緒は、別の研究から解ってきた。
・細菌感染症(炎症)の血管透過(漏出)性の亢進(こうしん、つまり、浮腫の誘発)は
細菌が産生するプロテアーゼが原因で起こる
ブラジキニンの生成などの炎症/起炎性因子の生成が
真の原因であることを見いだした(図1)。
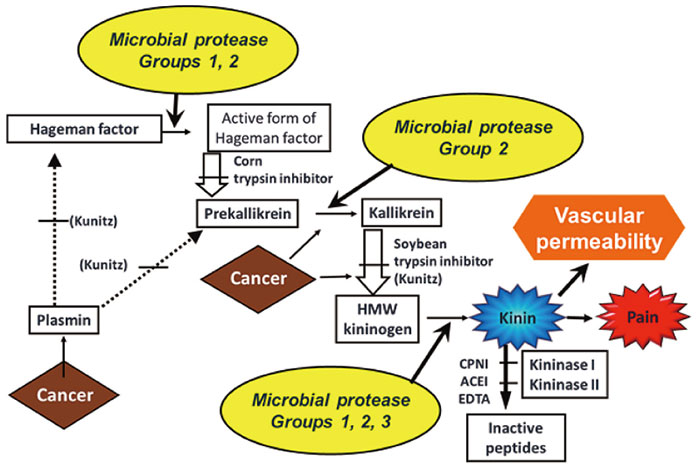
図1 ブラジキニン生成と分解のカスケード
・さらに、固型腫瘍部の血管透過性の亢進も同様にブラジキニンの生成によることを明らかにした。
この血管内腔から組織内への漏出性(leak)は、
血漿(けっしょう)タンパクなど高分子物質が特に顕著で、
低分子物質では正常組織も、炎症部もあるいは腫瘍部ともに同様である(図2)。
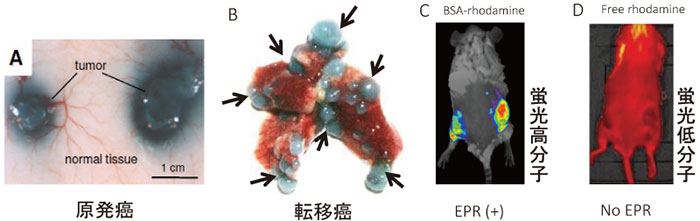
図2 Enhanced Permeability and Retention(EPR)効果
・さらに組織内へleakしたそれら高分子物質の回収(clearance)は
通常はリンパ系によるが、
腫瘍部では、それがほとんど滞っていることを見いだした
まず、われわれはヒトの肝臓癌症例に対して、
肝動脈よりスマンクス/リピオドールを動注すると、
圧倒的な肝腫瘍選択性にデリバリー(ターゲティング)できることを見いだした。
この薬物の腫瘍部濃度と血液内濃度の比は2,000倍にもなる。
つまり、この場合はX線CTによる造影した画像として検出でき、
しかもそれが癌部にピンポイントするので著効を示すと
同時に、副作用のない癌治療ができたのである。
今ではこの治療作戦も
EPRによるものであることが分かってきた。

図2 Enhanced Permeability and Retention(EPR)効果
高分子物質(エバンスブルーアルブミン複合体)(A、B)とアルブミン結合ローダミン(C)、および低分子物質ローダミン(MW約400)の原発移植癌(S180)(A、C)、及び肺転移癌(C26)に対する癌部選択的集積性を示す。
Dの低分子物質(ローダミン)は癌部に集積しない。
A-Dは各薬物を静脈内投与48時間後の画像。
転移部病巣にも高分子はよく集まる(矢印部)(B)。
このような腫瘍選択的EPR効果の原因に、
一つは癌組織と正常組織における血管の微細構造の違い
(血管の外側のペリサイトの欠損など、血管内皮細胞の不完全性、規則性の欠如など)(図3)
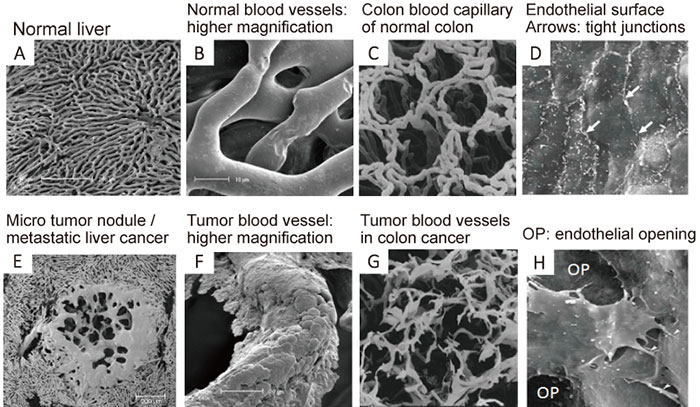
図3 電子顕微鏡写真
健常な血管(A-D)と腫瘍部血管の走査電子顕微鏡写真(本文参照)。Eの中央部は肝内転移癌の娘結節(経0.2mm)。
さらに血管の漏出性(透過性)を亢進する多くの血管作動性因子(表1)が
過剰に産生されていることの二つによることを証明した。
これら表1の因子は当然のことながら、腫瘍部のみならずその周辺の健常組織の血管にも作用する。
表1 EPR効果の因子
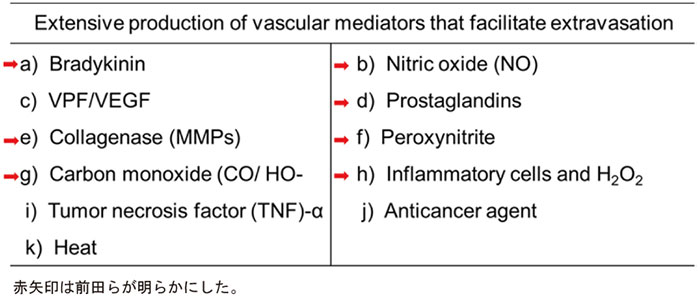
■EPR効果の定義として、特徴をまとめてみると表2のようになる。
表2 EPR効果の特徴と注意点

図2に示したように

図2 Enhanced Permeability and Retention(EPR)効果
移植癌にも、原発性癌にもあるいは転移癌にも、
高分子(ナノメディシン)は
EPR効果によって選択的に癌部に集まるが、
健常組織には集積しない。
これと同様に、図2のDのローダミンは低分子であり、腫瘍部選択性はないが、
高分子化(BSA化ローダミン/牛アルブミン結合体)では腫瘍部に選択的に集積する。
これは他の化学発癌剤で発生した自家癌の大腸癌でも乳癌でもみられるが、
正常組織には
高分子化薬剤は集まらず、EPR効果はないといえる。
ヒトの固型腫瘍でも証明されている。
これらの事象は、
かつて、放射性ガリウム投与によるシンチグラムによる癌部の画像化検出がよく行われたが、
実はEPR効果によるものであるといえる。
放射性Gaクエン酸[56Ga]は血中に投与すると
血中の分子量約9万のトランスフェリンと結合し、
高分子薬として挙動し、
その集積は、生体親和性の最も高い高分子であるトランスフェリンの集積となる、
故にEPR効果による腫瘍部への集積の現象に適合する訳である。
■EPR効果は
血管作動因子の過剰な生成に加え(表1)、
血管の細胞形態学上の微細構造の欠損にも起因している(図3)。
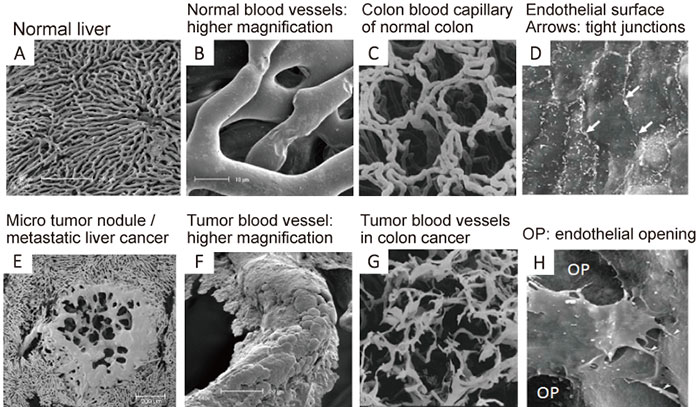
図3 電子顕微鏡写真
健常な血管(A-D)と腫瘍部血管の走査電子顕微鏡写真(本文参照)。Eの中央部は肝内転移癌の娘結節(経0.2mm)。
図3は担癌マウスの血液内に水溶性ポリマーの原料を注射し、それを血管内で高分子化させると、血管のキャストができる。
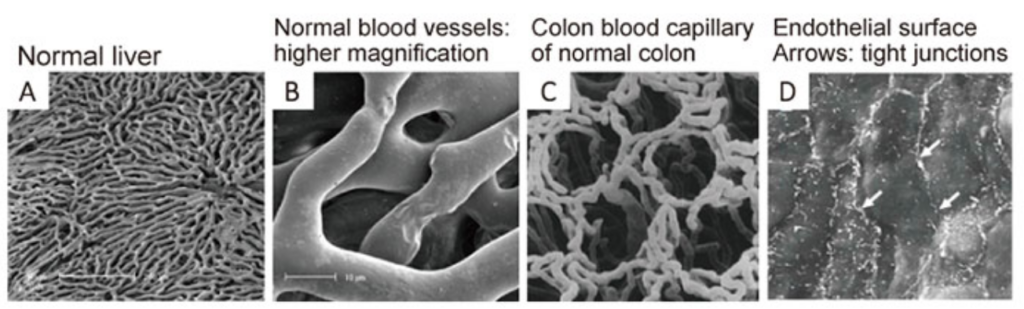
血管以外の組織のたんぱく質を濃KOH(水酸化カリウム)で溶かすと、全身の血管のキャスト(樹脂)ができる。それを走査顕微鏡で観察したのがこれらの写真(図3)である。
上段のA〜Dが正常の組織の血管で、
下段のE〜Hが癌部で、そこで高分子の樹脂(ポリマー)が血管の外側に漏出している様子が見られる(E、F)。
あるいは血管が途中で切断している場合がGである。
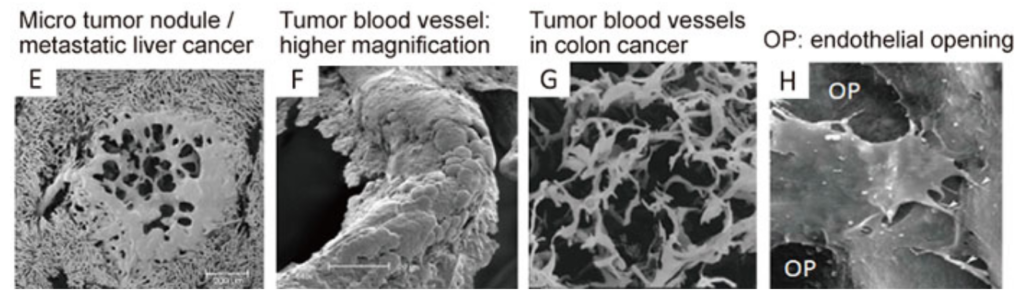
また、その腫瘍血管内皮細胞間の接合部(ジャンクション)に穴(OP. opening)があることを示している(H)。
これらに対し、正常の血管では漏出することもなくスムーズで、規則性があり、血管内皮細胞間同志の接着部(junction)はタイト(D白矢印)である。
─副作用のない固型癌に普遍的な制癌剤は可能だ─(3)
出典:産学官連携ジャーナルhttps://www.jst.go.jp/tt/journal/journal_contents/2018/06/1806-05_article.html
EPR効果のHeterogeneityとEPR効果の増強による腫瘍デリバリーの増強
1. EPR効果のHeterogeneity
EPR効果は固型腫瘍において普遍的にみられる現象であるが、
前報で述べたようにヒトの癌では、
マウスの実験腫瘍のように均一系ではなく、
おびただしいばらつきがあり( 表1)、
EPR効果のHeterogeneityの原因と考えられている。
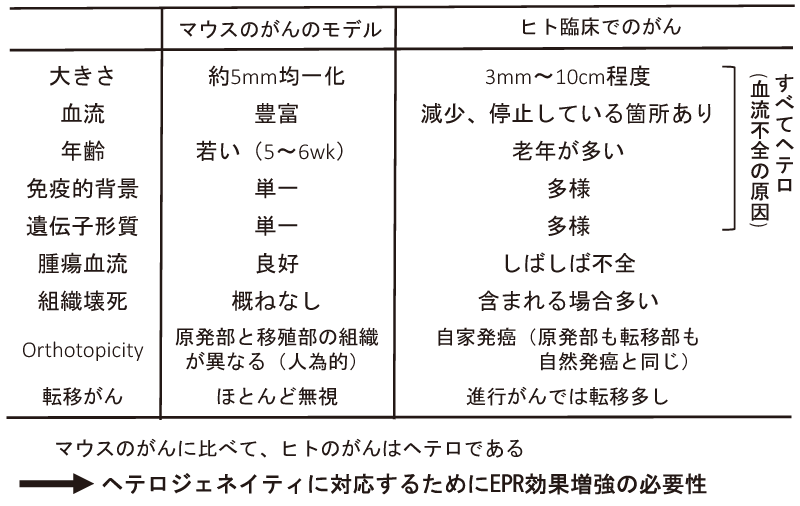
表1 マウスのがんとヒトの臨床でのがんとの違い
■まず、多くの基礎研究から臨床研究につなげる研究の前提として、
マウスなどの実験の腫瘍モデルと
ヒトの臨床の腫瘍の間に
大変な違いがあることを認識すべきであろう( 表1)。
・すなわち、マウスでは、
i)腫瘍サイズ(5~10mm)、ii)遺伝的系統は同一系、iii)週齢は5~6週齢と若いものが中心など、いずれも均一な系である。また、腫瘍の株も同一である。
このような均一な背景では生物統計学は有効である。
・一方、それが、ヒトの臨床の現場にあっては、
大きさも3mmぐらいから100mm、その体積ではばらつきは100~1000倍以上もあり、また、病理組織型、それに患者の大半は高齢者で遺伝的背景、ライフスタイル、食事の習慣など、すべての面で大きく異なっている。
それに、大きな腫瘍になると組織のかなりの部分は壊死(えし)しており、血管もないか、あるいはフィブリンの凝固物などが血栓を形成している(前述)。
そのような血管の組織(腫瘍部)では阻血になっており、血流もないか、あるいは乏しいものが多い。
また、腫瘍マスによる圧排(あっぱい)で、血流が抑えられているものも多い。
・さらにまた、血流は同じ肝臓にできた腫瘍でも
原発性肝癌(B型ウイルス、C型ウイルスなどが起因)と
他の臓器からの転移性肝癌では、
前者は血流が豊富であるが、後者は乏しく、全く異なる血流動態である。
このような背景では厳密な統計学は適用できないといわれている。
■次にもう一つの実験腫瘍の問題として、
・いわゆるヒトのゼノグラフトモデル(ヌードマウスnu/nuやスキッドマウスなど)では、
免疫反応の起こらない系である。
それらの系は炎症反応が起こらないので、それに伴う活性酸素の生成もない。
従って、同一系統内では、
炎症反応もなく活性酸素とそれによる突然変異もないので、
移植した癌のクローナリティーは同一で変化せずに維持されている。
・それに対し、ヒトの腫瘍では
当初の炎症から10年以上30年もかかって、
癌に進展したと考えられるものが多く(例えば、肝癌、すい癌、胆のう癌、胃癌、大腸癌、ATL:成人T細胞白血病、バーキットリンパ腫、その他)、
これらの腫瘍をヌードマウスモデルに移植し、継代してもあまり現実を反映したモデルといえない。
・さらにまた、実験腫瘍の移植部位の問題がある。
肝臓癌を、あるいは腎癌を背部皮下に移植しても、
肝臓や腎臓にある複雑な脈管構築はなく、
それはあくまでもマウスの実験室レベルの成績である。
さらに、癌細胞のダブリングタイムもマウスのものはおおむね早く(数日)、
ヒトの癌の数カ月と何十倍も大きく異なる。
上記のヒト化したと考えられているモデルのいわゆるゼノグラフトモデルのマウスは、
最近は頻繁に使われているが、いずれにしても免疫学的な能力は健常なヒトに比べ、異常な系である。
2. おびただしい遺伝子変異によるヒト癌の多様性
以上のような生物学的な腫瘍のHeterogeneityに対し、
上述のようにヒトの腫瘍の形成には10~30年もの長い期間を要し、
その間病巣では炎症反応と類似の反応、
例えばスーパーオキサイドとかNOなど、活性酸素の生成がみられ、それは変異原となる。
その結果、その遺伝子変異の多さは驚くべき数になる。
この分野の泰斗のVogelstein(米国ジョンズホプキンズ大学)によるとヒトの肺癌の同一患者自身の癌細胞でも遺伝子多型は200以上数百もあるという(表2)。
表2 各種固型腫瘍・血液がんの同一患者内にみられる変異癌細胞のタイプの数
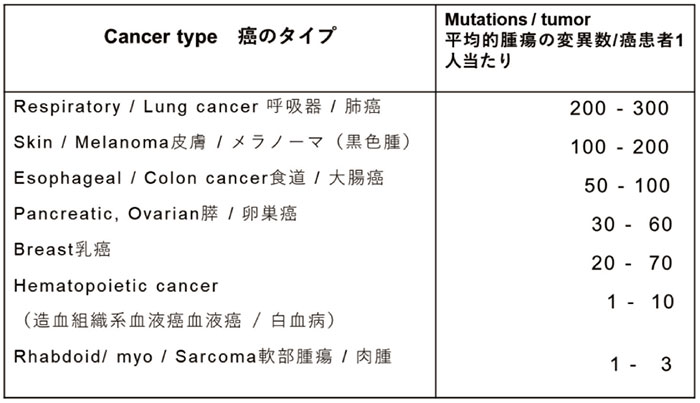
このおびただしい癌細胞の遺伝子変異は、
原発部腫瘍はもちろん転移部腫瘍でもみられる。
このような変異が多い固型癌に比較し、
血液癌(白血病)や軟部組織の腫瘍では、1~10種程度と少ない。
変異がなければ、グリベックのような抗慢性白血病薬の特効薬があれば、
著明に効果が見られる(>奏効率90%)。
以上の事実は、
癌治療の原理としての標的分子や
抗原エピトープを狙う分子標的薬や抗体医薬の標的も変わっていることを示し、
そのような対癌戦略は効果がないといえる。
このような事態に対してもEPR効果による戦略はより普遍的で、
そのエンハンサーの併用はますます重要になってくると信じている
3. EPR効果の増強による腫瘍デリバリーの増強
上述のように、血管の塞栓(そくせん)、腫瘍のマスの増大による血管の圧排などに起因して固型腫瘍の血流はしばしば不全となっている。
この類似例としては狭心症で、
これは心臓の冠状動脈の血流不全によるのであるが、
その対策として、最もよく知られているのがニトロ剤の投与である。
古くから知られているニトログリセリンやニトロールⓇ(ISDN [isosorbide dinitrol])などは経口/経皮投与で急速に血中に移行し、亜硝酸(NO2–)イオンになる。
虚血局所、腫瘍部などpO2の低いところでは、NO2–はNOに変換される(図1)。
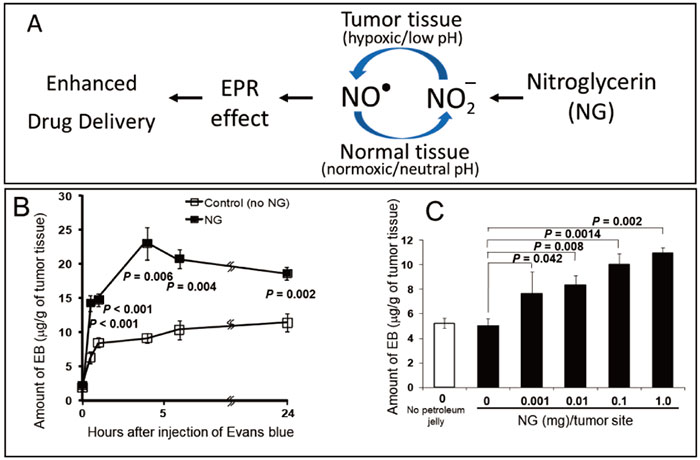
図1 ニトログリセリン塗付によるEPR効果の増強、腫瘍血流と高分子薬物の腫瘍内集積の増強
(A)は酸素分圧の低い腫瘍部では亜硝酸イオンNO2–はNOに変換され、EPR効果を高めるメカニズム。(B)、(C)はニトロ剤投与後の高分子薬物の腫瘍集積の時間依存性(B)と用量依存性(C)。
NOは血管拡張作用を発現し、
血管拡張と同時に血管の透過性(EPR効果)の亢進をもたらす。
さらにNOそのものも腫瘍の増殖に抑制的に作用するので、好都合である。
このメカニズムと臨床での実証データは参考文献11、12、13に示したとおりである。
図1のように、ニトログリセリンの例でもエバンスブルー(アルブミンと結合し分子量7万)の腫瘍デリバリーは2~3倍増大する。
しかもこのニトロ剤は、正常組織では作用しない(NO2–からNOの変換がない)ので、好都合である。
このような手法をわれわれは、高分子化ピラルビシンのパイロットスタディに使用し、好成績を上げている。
このニトロ剤の投与は、
まれに低血圧のヒト(最高血圧が100以下)では万一の血圧低下(ショック)の心配があるので、そのようなケースではACE(AngiotensinⅠ変換酵素)阻害剤を用いることにより可能になる。
これも腫瘍特異的なブラジキン生成にリンクした(図2)局所のキニンの増加(分解の抑制による)により、ニトロ剤と同様のEPR増強効果を示すことができた。
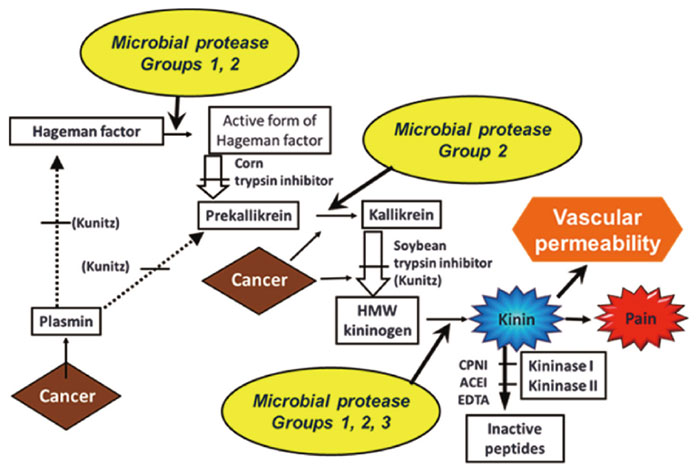
図2 ブラジキニン生成と分解のカスケード
これは乳酸菌を静注したときでさえもこの細菌の腫瘍デリバリーを飛躍的に増強する。
実験モデルの腫瘍は前述のように早期(小型)の癌であるが、
臨床を考えると、
高度進行癌に対しても有効性を評価できるモデルがより重要と考えられる。
われわれもこの点を考慮した実験を行い好成績を得ている。
腫瘍はDMBA(ジメチルベンズ[a]アントラセン)投与の自家発癌の乳癌のラットモデルである。
通常は径が5~6nmの腫瘍に対して評価を行うが、
今回の例は20~30mmになったものを、高度進行癌のモデルとして治療対象に選んでいる。
高分子型制癌剤P-THP単独投与群と
ニトロ剤併用群との比較で、
それぞれ4回投与で、投与後130日目の評価である(未発表データ、図3)。
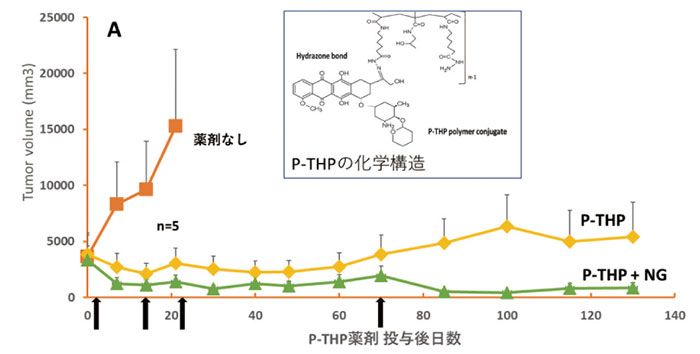
図3 P-THPとニトロ剤併用の抗腫瘍効果
・DMBA誘発高度進行ラット乳がんモデル
腫瘍は治療開始時、
すでに3000mm3もある乳がん(NG)で、
薬剤なしの群は3週目で全例死亡。
薬剤(P-THP)投与時にラットあたりニトログリセリン(軟こう)0.2mg塗付。
P-THPとニトロ剤(NG)は矢印の日に計4回iv投与。
NG併用投与群で約4カ月で腫瘍はほぼ消失で再発はない。
SDラット、5週齢、
使用。P-THPは両群とも5mg/kg(THP当量)。
P-THPは高分子のヒドロキシプロピルメタアクリルアミド(HPMA)ポリマー結合THP(ピラルビシン)であり(図3)、
その平均分子量約4万で、ヒドラゾンを介して結合している。
このものの腫瘍選択的集積性は既に報じたとおり極めて顕著である(図4のB)。
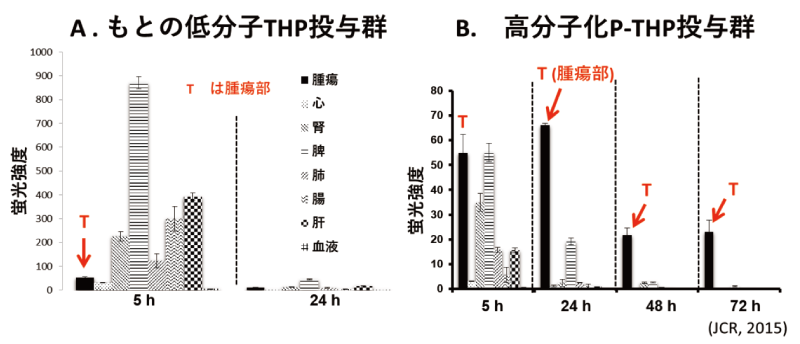
図4 P-THPミセル製剤の担癌(S-180)マウスにおけるもとの低分子THP(A)と、高分子結合THP(B)の各組織分布の大幅な違いと、HPLCによるFree THPの含量の解析。Aの低分子THPと比較すると、Bの各組織でポリマーから遊離されたTHP(薬効本体)は腫瘍部でのみで薬物が放出されている(B)。
・以上のような知見に基づきわれわれは、
P-THPのパイロットスタディを行った。
その例は参考文献11、12、13にあるように副作用がない状況で、充分な抗腫瘍効果がみられており、今後の臨床展開が楽しみである。
4. EPR効果のさらなる展開:PDT(光照射療法)への応用
図5にあるように、
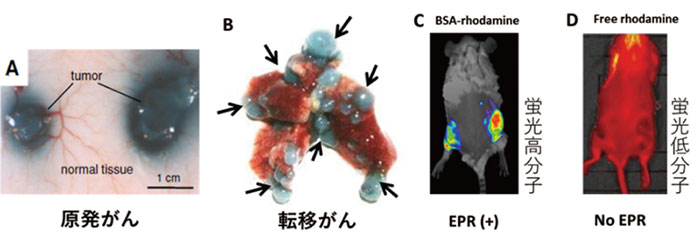
図5 Enhanced Permeability and Retention(EPR)効果
蛍光性のナノ粒子(ローダミン化BSA)を静脈内に注射すると、
それは腫瘍部に選択的に集積し腫瘍が蛍光画像として検出できる。
この時用いる蛍光分子を光増感剤(PS:光照射で活性酸素「一重項酸素」を発生するナノ分子)を投与すると、
腫瘍局所は光により蛍光像として検出が可能となり、
同時に活性酸素により腫瘍組織を殺傷する。
図6は前記のP-THP(これは蛍光を発する)を投与したマウスC26腫瘍を移植した例であるが、
EPR効果により、長時間になる程、腫瘍集積性が増強されることがよく分かる。
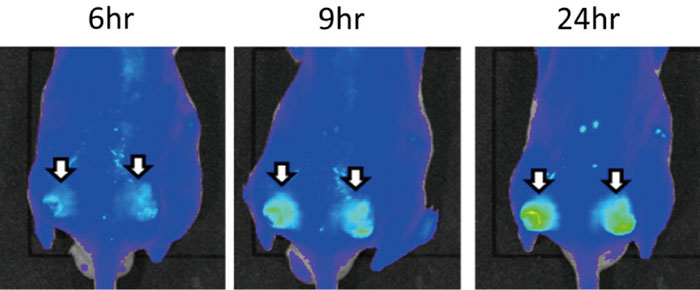
図6 P-THPの腫瘍蛍光検出
白矢印は腫瘍部を示し、その蛍光強度は時間とともに強くなっている。
これは高分子薬P-THPの示すEPR効果とその時間的増強を示す例である。経過時間を上に示した。
高分子物質(エバンスブルーアルブミン複合体)(A、B)とアルブミン結合ローダミン(C)、および低分子物質ローダミン(MW約400)の原発移植癌(S180)(A、C)、及び肺転移癌(C26)(B)に対する癌部選択的集積性を示す。
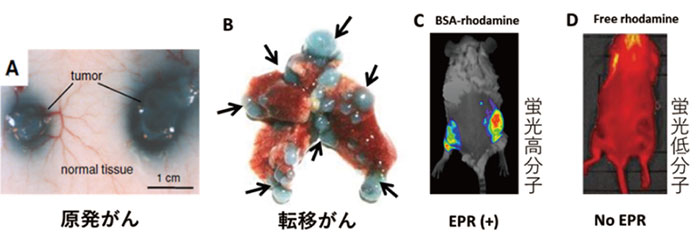
Dの低分子物質(ローダミン)は癌部に集積しない。
A-Dは各薬物を静脈内投与48時間後の画像。
転移部病巣にも高分子はよく集まる(矢印部)(B)。
表3 癌治療の失敗例と理由= EPR概念の欠如

われわれはこのPSとして、
亜鉛プロトポルフィリン(ZnPP)を前述のHPMAポリマーに結合させたものを用いている。
ZnPPは毒性はなく、
それ単独でも抗腫瘍効果があるが、
光照射による活性酸素により強力な殺細胞効果を発揮する。
表3で示したように、PDTの原理は110年以上前に知られていたが、
EPR効果を目指したナノ化PS粒子の作成により、
初めて手術によらずに多くの固型癌が治療できそうである。
その対象としては、
皮ふ癌、乳癌、食道癌などのセンチネルリンパ節、管腔臓器の癌(口腔、咽頭、食道、胃、腸、膀胱、子宮、横隔膜、腹膜、胸腔、その他)への応用が考えられる。
同様のことがBNCT(硼素熱中性子捕獲療法)についてもいえる。
これらはEPR効果を充分に利用したナノメディシンとそのエンハンサーを含め、
より巧妙な対癌戦略になると考えられる。
─副作用のない固型癌に普遍的な制癌剤は可能だ─(4)
出典:産学官連携ジャーナル https://www.jst.go.jp/tt/journal/journal_contents/2018/07/1807-09_article.html
EPRに基づく腫瘍選択性:実例と展望
■EPR効果のある制癌剤(高分子化薬)全てで
画期的な制癌効果が得られるかというと必ずしもそうではない。
ERP効果は標的腫瘍までの三合目-四合目までの話で、
運よく腫瘍局所まで薬剤が到達したとしても、
詳しくはそれに含有されている薬物の活性本体
(API:active pharmaceutical ingredient)が
癌細胞の標的に結合するかどうかである。
これまで数多くのナノメディシンが開発されてきたが、
真に頂上まで到達した制癌剤はない。
市販品ではドキシル(ドキソルビシン含有リポソーム)やアブラキサン(アルブミン結合したタキソール)が有名であるが、
前者は安定性が強すぎて、リポソームからAPIの放出が遅すぎて、毒性は1/10であるが薬効はもとのドキソルビシンと変わらない。
後者はこの高分子複合体からの薬物の放出が早すぎて副作用も強い。
◆筆者らのP-THPは、
ほぼ九合目から十合目にあると考えている。
図1のBはP-THPの投与後の体内分布であるが、
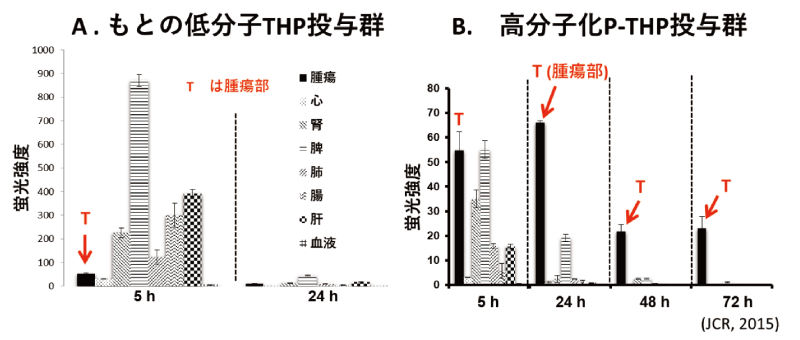
図1 P-THPミセル製剤の担癌(S-180)マウスにおけるもとの低分子THP(A)と、高分子結合THP(B)の各組織分布の大幅な違いと、HPLCによるFree THPの分布の定量。Aの低分子THPと比較するとBの各組織でポリマーから遊離されたTHP(薬効本体)は腫瘍部でのみで薬物が放出されている(B)。
これは図2にあるようなEPR効果による腫瘍局所に選択的に集積し、
腫瘍局所の低いpHでAPI(ピラルビシン、THP)を放出する。

図2 ナノメディシンを用いた腫瘍選択ターゲティングに関わる各種因子
腫瘍選択的デリバリーの3段階(EPR効果、局所酸性pH、細胞内トランスポーター)
これが癌細胞に高発現しているグルコーストランスポーターなどにより、
急速に細胞内へ取り込まれ、
その効率は
同じアントラサイクリン系のドキソルビシンやエピルビシンの
同じ高分子結合物よりも30~100倍もよい。
P-THPのみスフェロイド腫瘍によく浸透する(後述)(図3)。

図3 P-THPとポリマー結合ドキソルビシン(P-DOX)のヒト膵癌細胞のスフェロイド体に対する浸透性の比較。両者とも同じポリマー(HPMA)を結合したコンジュゲートであるが、唯一の違いは、THPはDOXにピラニル基を1個付加した点である。写真はin vitroで形成されたスフェロイドにP-THPおよびP-DOXを両薬剤を添加培養し、蛍光顕微鏡で見た像である(本文および参照)
以上の三段階の腫瘍選択的メカニズムにより、
正常/健常組織細胞に対する毒性は極めて低い。
このP-THPをヒトに投与した医師主導のパイロットスタディの結果に対する
数多くの患者さんのコメント、有効性は
奥野修司氏の著書に詳しい。
また、末期StageⅣの前立腺癌の症例報告にも詳しい。
・このような優れた臨床および基礎データの裏付けとして、
P-THPの静脈内投与後の腫瘍内の薬物P-THPの分布量を、
投与後6時間から72時間までみているが、
投与後24時間から96時間経た時点でも、
薬物は腫瘍部のみに顕著に集積している(図1のB)。

図1 P-THPミセル製剤の担癌(S-180)マウスにおけるもとの低分子THP(A)と、高分子結合THP(B)の各組織分布の大幅な違いと、HPLCによるFree THPの分布の定量。Aの低分子THPと比較するとBの各組織でポリマーから遊離されたTHP(薬効本体)は腫瘍部でのみで薬物が放出されている(B)。
・これに対し低分子のもとのTHPは腫瘍部へは、
6時間後にわずかに集積するが、
ほかの正常臓器(腎、肝、肺など)にはその数倍~10倍以上集まっている。
腫瘍部にはほんのわずかしか集まらないのである。
これが現実の標準治療の例である(図1のA)。
薬がEPR効果を発現するためには、
高分子化によって高い血中濃度を維持する必要がある。
低分子のTHPやドキソルビシンの血中半減期は約2時間くらいであるが、
P-THPはヒトでは投与1週間後でも
血中に投与初期の10%は残存している(図省略)。
P-THPが腫瘍組織の酸性pHに応答してAPIのTHPを放出する様子は文献に記している。
さらに、このP-THPが、腫瘍細胞に対しより選択的に
かつ類似のドキソルビシンとは対照的に、
腫瘍細胞に極めてよく取り込まれることをわれわれは見いだしている。
ドキソルビシンは同じアントラサイクリン系制癌剤であるにもかかわらず、
腫瘍細胞へは極めて緩やかにしか取り込まれない。
その顕著な例として、
一般に治療が困難なスフェロイド(肺癌細胞の胸水や脳腫瘍のずい液中にみられる腫瘍細胞の浮遊凝集塊)に対しても、
われわれのP-THPは充分浸透するが、
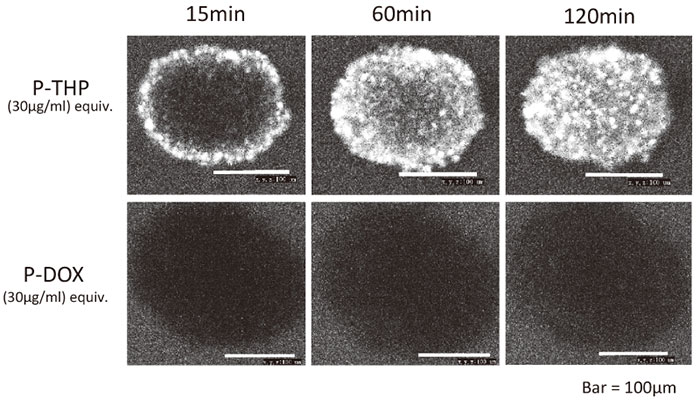
ドキソルビシンの場合は同一の高分子結合体の場合も低分子の場合でも1/30〜1/100しか浸透しないのである(図3)。
このようにP-THPはまさに副作用のない、
人にやさしく、
かつ有効性の高い制癌剤である。
われわれとしては、このような薬剤開発に対してこそ、
公的なサポートが待たれるところである。
このP-THPは、
いわゆる制癌剤に一般的に尋ねられるdose limiting toxicity(用量依存的に最初に出現する毒性)、
例えば、骨髄抑制、腎毒性、肝、腎、心毒性、抹梢(まっしょう)神経毒性、消化管障害、脱毛、食欲不振、嘔吐(おうと)、悪心など、通常の治療用量(THP当量)の25~75mg/body(60kg body wt)では、
毎週~4週ごとの長期間の投与ではみられていない。
さらに注目すべきは、
上記症例報告にもあるように遠隔転移(肺、骨、リンパ節)にも有効であったので、まさにEPR効果のProof of evidenceといえる。
おわりに
EPR効果は、この論文では制癌剤を中心に述べてきたが、
もともとのその発見が、
炎症(感染症)に対してであった。
そのことから考えると、抗炎症薬も、抗感染症薬についても応用が当てはまるので、そのいずれにおいても副作用の軽減と薬効の改善が期待される。
十数年前、メルク社(MSD)の社長は、20世紀はSeed finding の時代であったが、21世紀はデリバリー(DDS)の時代になろうと述べられた。
まさにEPR効果発見33年にして、ようやくその真価が理解されてきたと思っている。
われわれのEPR発見の文献は、
世界的情報会社のトムソン・ロイター社の世界で最も影響力のある論文として、その化学部門のCitation Laureateに選ばれたが(世界のTop3)、
それを発表した雑誌のCancer Research誌(創刊ほぼ100年前)の原著論文約10万報のうちでも引用がトップであるといわれている。
表1 癌治療の失敗例と理由=EPR概念の欠如

さて、以上の話は化学療法についてであるが、
表1に記しているPDT(光照射療法)は、
われわれのナノ粒子光増感剤(P-ZnPP)により癌治療に革命をもたらすと考えられており、
現在鋭意共同研究を進めている。
また、BNCTも現在新しいナノ化ホウ素剤を確立しており、これも放射線照射治療に新しいチャプターをもたらすと考えられ、鋭意研究を進めている。
いずれについてもEPR効果に基づく癌治療法により、一つのエポックを開けると信じている。
~西日本新聞 2021/5/21 6:00の記事より転記~
出典:https://www.nishinippon.co.jp/item/n/742118/
前田浩氏が死去 がんの画期的治療技術開発 熊本大名誉教授

研究成果を説明する前田浩氏=2019年10月、熊本市中央区
がんの画期的な治療技術を開発し、ノーベル賞の有力候補としても名前が挙がった熊本大名誉教授の前田浩(まえだ・ひろし)氏が18日午前6時25分、肝不全のため熊本市の病院で死去した。82歳。兵庫県宍粟市出身。葬儀・告別式は近親者で行った。後日、お別れの会を開く予定。
東北大大学院修了後、米ハーバード大がん研究所主任研究員などを経て、1971年に熊本大医学部へ。
世界初の高分子型制がん剤「スマンクス」を開発した。
86年には、高分子薬剤が腫瘍に集積されやすいという「EPR効果」を発見し、大学院生だった松村保広氏(国立がん研究センター客員研究員)と共同論文を発表した。
その後も、患部に薬剤を効果的に送り込む「ドラッグ・デリバリー・システム(DDS)」の研究を進め、2010年に西日本文化賞を受賞。
16年にはトムソン・ロイター引用栄誉賞を松村氏と共同受賞し、近年はノーベル賞に近い候補として注目されていた。