出典:特集 医療を支える高分子 筑波大学数理物質系 長崎幸夫教授 工学博士(専門は生体機能材料)https://talc.ims.tsukuba.ac.jp/~nagasaki_lab/data/review/reviews/2017polymer.pdf
低分子合成薬からタンパク質を中心としたバイオ医薬品へのパラダイムシフトが現実のものになってきた。
しかし副作用のない効果的薬物治療薬の開発はいまだ緒に就いたばかり。
高分子を利用することで巧みに欠点を回避し、患者の生活の質(QOL)を上げるナノメディシン開発のエッセンスをひもとく。
1.はじめに
19世紀の終わり頃、メチレンブルーがウサギの神経末端だけを染色することからエールリッヒは、化学物質をうまく選べば、身体の中の健康な部分にはまったく影響を与えず、病気に侵されている部分を直接攻撃することが可能な魔法の弾丸を作り出せると考えた。
21世紀に入り夢の新薬と言われた分子標的薬が実用化し、エールリッヒの発想が実現した。
では、世の中から癌患者がなくなったであろうか?
答えは否、
現実には癌患者の死亡数は年々増加の一途を辿っているのである。
患者の苦痛を低下させ、効果を向上させるためには分子標的薬の効率をさらに上げるだけなく、新
しい「くすり」の概念が不可欠である。
本稿ではこれまで低分子合成化合物が主流であった「くすり」から「高分子を薬にする」ということで新しい創薬領域へと展開する話を筆者らの例を中心に概説する。
2.高分子が活躍する最近の創薬
分子標的薬などのタンパク質や核酸を医薬に用いようとした場合、
バイオアベイラビリティー(生物学的利用能 )がきわめて短いだけでなく、
その抗原性や腎臓からの排出など、
さまざまな問題が避けられない。
米国Rutgers大学(当時)のDavisらはタンパク質にポリエチレングリコール(PEG)を共有結合で結合させるという奇抜なアイディアで、
その抗原性やバイオアベイラビリティーの延長ができることを示した(図1参照)1)。
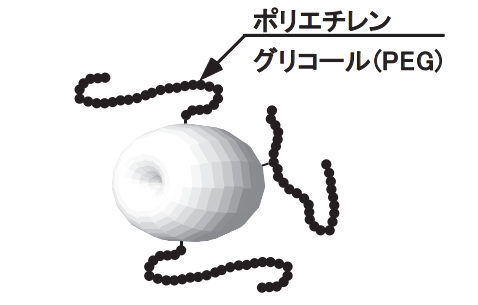
図1 タンパク質への合成高分子の修飾(修飾により①水溶性の向上,②タンパク分解酵素耐性の向上,③免疫原性の低下,④腎代謝速度の低下(バイオアベイラビリティーの延長)が達成される)
デリケートなタンパク質に合成高分子を共有結合させるという無謀とも言える試みから初の高分子化
薬物が誕生した。
現在、Davisらを中心に設立した製薬ベンチャー、Enzon Pharmaceuticsが大きく成長している2)。
タンパク質のPEG化に関しては最近の総説を参照されたい3)。
わが国では1986年、熊本大学前田らが高分子物質が癌に受動的に集積するEPR効果(Enhanced Permeability and Retention effect=固形癌血管漏出性と漏れ出した高分子のその場所での滞留性の亢進)を発見した4)。
すなわち血流で運ばれる
低分子物質は正常組織、固形癌組織を問わず血管から漏出するのに対し、
高分子物質はそのサイズにより正常組織内の血管からは漏出することはない。
一方、固形癌組織内の血管は、
その構造が正常組織内の血管に比べて粗雑で、
低分子物質のみならず高分子物質も容易に血管から癌組織へ漏出する。
癌組織内に漏れ出した低分子物質は拡散や毛細リンパ管によって回収されるのに対し、
高分子は拡散性が乏しく、毛細リンパ系での回収が間に合わない。
このため、長時間にわたり癌組織内に蓄積される。
この結果、固形癌組織には、高分子物質が選択的に滞留・蓄積することになり、これがEPR効果と名付けられた(図2)。
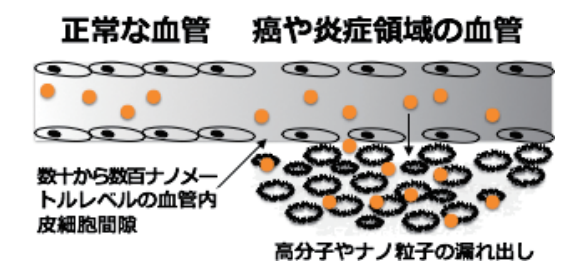
図2 EPR効果の概念図(透過性の高い腫瘍新生血管からの漏れ出しとともにリンパ系の未発達による高分子化合物の集積が見られる)
そこで前田らはポリ(スチレン-co-無水マレイン酸)共重合体に抗癌剤、ネオカルシノスタチンを結
合し、
1993年に世界初の高分子型抗癌剤スマンクスとして認可・販売された
(現アステラス製薬)5)。
前田らの第二弾高分子薬P-THPは
まだ認可はされていないものの、
副作用のない抗癌剤として
臨床研究が続けられている6)。
3.抗酸化ナノメディシンの設計
秦の始皇帝が「不老長寿」を欲した7)ように、世の中ではアンチエイジングが盛んである8)。
1970年 代頃から活性酸素種(ROS)が悪の根源であると指摘され、調べてみると、老化だけでなく、ほとんどの疾病に関与していることがわかってきた9)。
そこでROSを消去するために、ビタミンCやビタミンE、クルクミンなどの天然物に加え、さまざまな合成抗酸化剤が開発されてきているものの、効果のある抗酸化剤はない。
Bjelakovicらは2007年、これまで発表されてきた385報の論文から68件の無作為研究を調査し、23万人
以上の臨床試験データから抗酸化剤に対して次の結果をまとめている10)。
i)ベータカロチンは7%、ビタミンAは16%、ビタミンEは4%死亡リスクを高める。
ii)ビタミンCとセレニウムイオンは、さらなる検討が必要である。
健康になるどころか、抗酸化剤を毎日とると寿命が縮むのである。
なぜだろう?
実は細胞はミトコンドリア内でグルコースを酸化してエネルギーを得ており、
このときに大量のROSを産生している11)。
低分子抗酸化剤が正常な細胞やその中のミトコンドリアに入り込み、
電子伝達系をはじめ、重要なレドックス反応を阻害してしまうとエネルギーが得られないのである。
ROSが「諸刃の剣」であるがゆえに、ビタミンや合成抗酸化剤の効果が見られない。
つまりi)の結果は副作用がでる濃度が治療効果がでる濃度より低い(セラピューティックウィンドウ がない)ことを示しているのである。
筆者らは「代謝可能な高分子に抗酸化能を固定する」という単純な発想であるものの、
高分子化することにより正常細胞の細胞膜やミトコンドリア膜の透過を抑制し、
癌や炎症部位で効果的に抗酸化能を発揮するナノメディシンを設計した12)。
具体的には図3に示すように、自己組織化能や環境応答能を有するブロック共重合体に触媒的に活性酸素
消去能を有するニトロキシドラジカル(TEMPO)を共有結合で導入した。
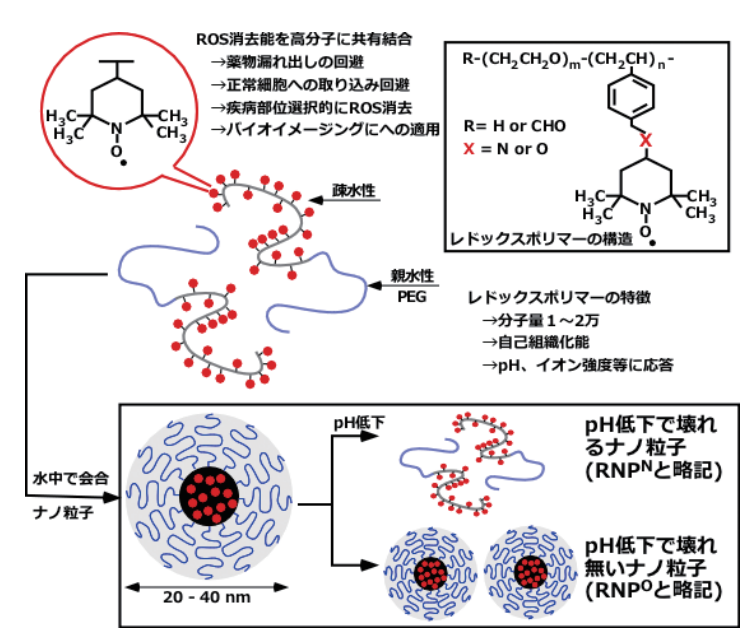
図3 悪玉活性酸素種を選択的に除去する新しいレドックス高分子の設計
両親媒性のこのレドックスポリマーは水中で自己組織化してナノ粒子となる(レドックスナノ粒子、RNPと略記する)。
RNPの安全性を確かめるため、
たとえば生まれたばかりのゼブラフィッシュを入れた水槽に加えてみると、
水溶性の低分子4-ヒドロキシTEMPOは30 mMの濃度で12時間後に全滅するのに対し(ほぼ即死)、
RNPでは同濃度で5日後でもほぼ生存していることを確認した(図4)13)。
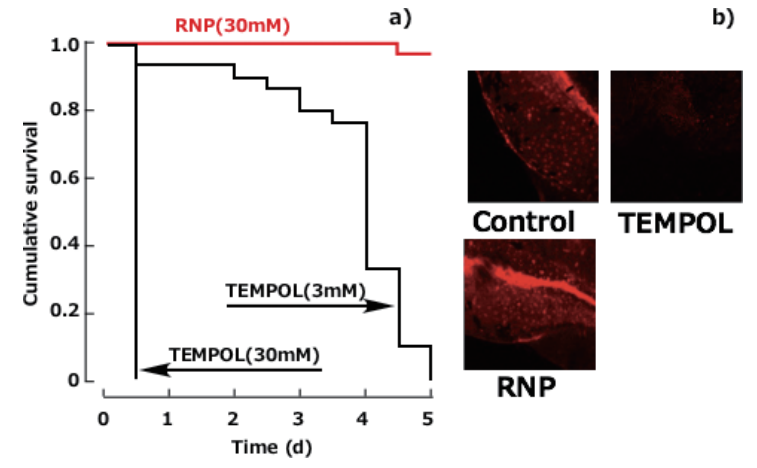
図4 ゼブラフィッシュに対する抗酸化剤の効果(赤い蛍光はゼブラフィッシュの健康なミトコンドリアをあらわす.TEMPOLではほぼ全滅.Elsevierから許可を得てref.13を改変して掲載.)
このように分子のサイズを制御することにより強い抗酸化能を有するにもかかわらず、生存に大切な細胞内レドックス反応を保護することが可能となった。
4.抗酸化ナノメディシンの機能
図3に示すように、TEMPOのポリマーへの連結基としてアミノ基またはエーテル基結合の2種類を用いた。
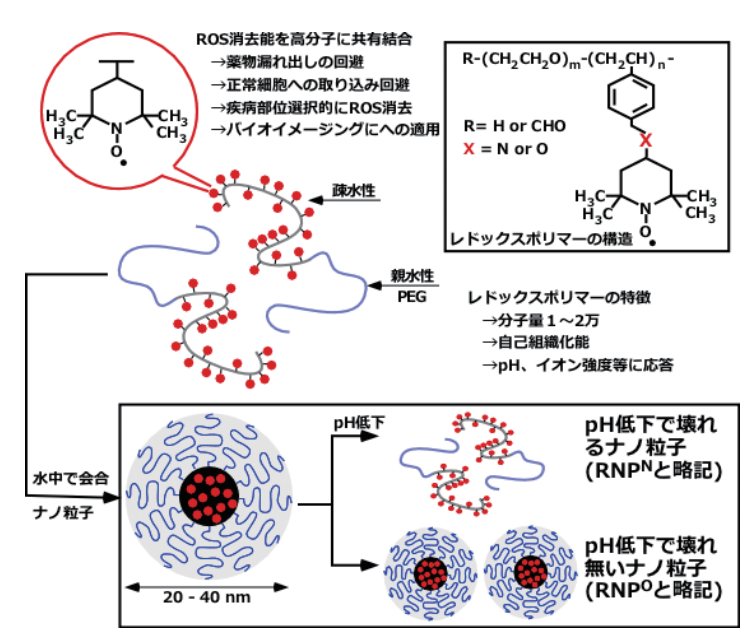
図3 悪玉活性酸素種を選択的に除去する新しいレドックス高分子の設計
アミノ基で結合したレドックスポリマーからなるナノ粒子(RNPNと略記する)は
pHの低下にともないアミノ基がプロトン化し、親水化するため疎水性凝集力が弱まり、ナノ粒子が崩壊する。
この酸性側での粒子の崩壊は、図5aに示すように、動的光散乱測定により、pH 7以下で光の散乱強度が低下することから確認される14)。
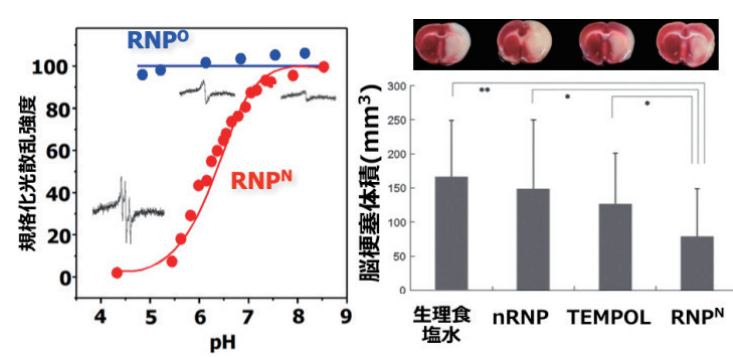
図5 左:レドックスナノ粒子(RNP)のpHに対する応答性(RNPOはpH変化にかかわらず光散乱強度が変化しないのに対し,RNPNではpH低下にともない光散乱強度が低下し,電子スピン共鳴スペクトルが変化しており,崩壊していることが確認される),
右:脳虚血再灌流障害脳に対する2,3,5-triphenyltetrazolium chloride染色(赤く染まっているところが生存組織,生理食塩水,活性酸素除去能を有さない粒子,低分子TEMPOLに比較してRNPNでは優位に脳梗塞サイズを減少させており,再灌流時の活性酸素種を効果的に消去する効果が確認される).Lippincott Williams & Wilkinsから許可を得てref.15を改変して掲載
また、同図内に示すように、中性以上ではニトロキシドラジモデルマウスへRNPOを経口投与すると、がん細胞内には取り込まれるものの、正常細胞には取り込まれないことが確認された(図6a)16)。

図6 大腸癌に対するイリノテカンとRNPとの併用投与.a)の縦軸はRNPOの量に比例する.正常細胞にはほとんど入っていない.b)の縦軸は大腸癌の数とサイズを数値化したもの,イリノテカン+RNPO併用で癌の成長が抑制している.c)の縦軸は下痢の程度をスコア化.(Elsevierから許可を得てref.16を改変して掲載)
そこで副作用がきわめて強いイリノテカンを用い、RNPOとともに経口投与試験を行ったところ、イリノテカン単独ではほとんど効果がない低容量条件下で併用投与では腫瘍成長抑制効果が顕著にあらわれた(図6b)。
一方、イリノテカンの消化管障害により惹起する下痢は併用投与では強く抑制された(図6c)。
このようにRNPOは抗がん剤の効果を上げ、副作用を低減するナノアジュバントとして期待できる。
pH低下で崩壊するRNPNの話に戻る。
RNPNを経口投与すると当然ながら胃でばらばらに崩壊する。これが腸で吸収されて血中に取り込まれる。
したがってRNPOとは全く異なった体内分布を示す。
アルツハイマー病の原因は明らかではないが、脳に大量のβアミロイド(Aβ)が集積し線維化を通して炎症を起こし、ROSを産生する。
これが神経細胞を破壊するという結果は同じである。
炎症を起こすとBBBと呼ばれる血液脳関門は破壊されるので、筆者らのレドックスポリマーは脳にまで到達するのである。
詳細は省略するが、脳に大量のAβを発現するSAMP8マウスにRNPNを経口投与し、プールの中を泳がせて休むまでの時間を計測 する(Morris Water Maze試 験 )とSAMP8マウスの認識能は4週間後に正常マウスと同等まで向上した(図7)17)
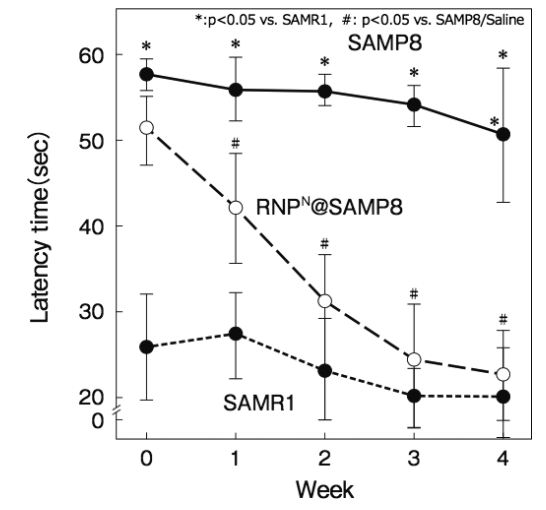
図7 加齢促進マウス(SAMP8)に対するRNPNの効果(Pub.Lib. Sci.から許諾を得てref.17を改変して掲載)
5.放射能プロテクション
誌面の都合上詳述はほかに譲るが、放射線に暴露されるとROSが遺伝子や細胞膜障害を起こし、髪の毛や骨髄細胞のような分裂の激しい組織に大きなダメージを与え、限界を超えると死に至る。
過剰のROSを取り去るRNPを
マウス皮下に投与し、7.5 Gy(γ線で7.5シーベルト相当)のX線に暴露させた。
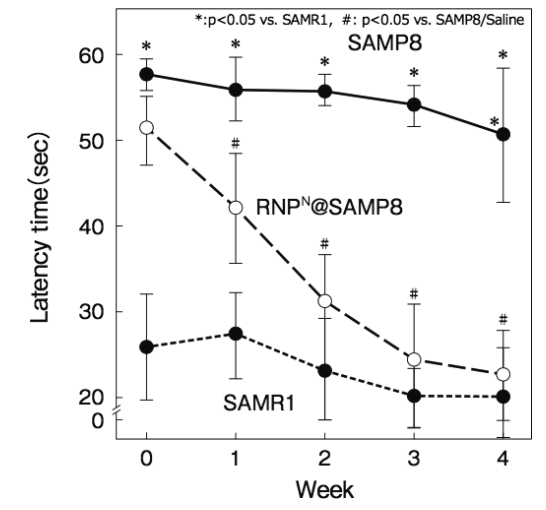
図7 加齢促進マウス(SAMP8)に対するRNPNの効果(Pub.Lib. Sci.から許諾を得てref.17を改変して掲載)
図7に示すように臓器からの出血がRNP投与群ではほぼ完全に抑えられている(図8)18)。
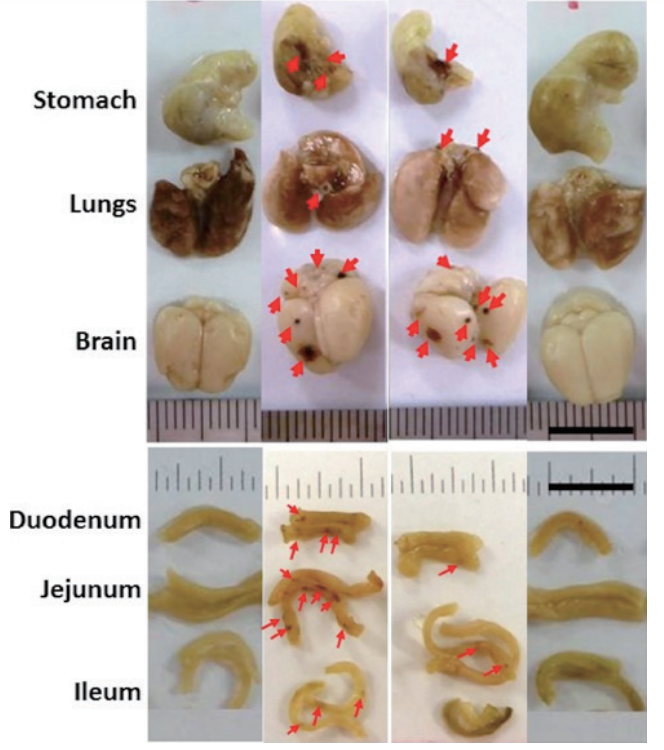
図8 7.5 Gy被爆2週間後の各種臓器(出血点に矢印,暴露群,低分子TEMPO-NH2群では大量の出血痕が見られる,RNPN投与群ではほとんど出血が見られない.投与24時間後に被爆,Elsevierから許可を得てref.18を改変して掲載.)
6.0 Gy照射条件では急性致死を起こさないものの、およそ1年半で完全に死滅する。
しかしRNPを皮下投与した場合、実に80%が生存していることが明らかになった(データ略)。
福島原発を見るまでもなく、高度放射線汚染地域での作業、宇宙旅行などのニーズに加え、
癌三大療法の一つとして
放射線治療でその副作用に苦しんでいる患者に対する
QOLの向上が期待される。
6.レドックスポリマーの医療機材への展開
ROSを効果的に消去するレドックスポリマーを生体環境下でゲル化させるインジェクタブルゲルやレドックス吸着剤、表面コーティング剤などさまざまなアプリケーションを展開中であるが、誌面の都合上割愛する。詳細は下記を参照されたい19)。
7.おわりに
柳から抽出された鎮痛作用を有するサリチル酸をアセチル化すると、
その強い消化管障害が抑えられることがわかり、
世界初の合成薬として人類に貢献してきた。
以来100年以上にわたって有機合成を基盤とする“くすり”の研究開発が行われ、たくさんの人々を救ってきた。
しかしながら「作用」と「反作用」は表裏一体、トレードオフの関係から逃れられない。
ナノメディシンの概念が、
これまで解決できなかった問題を抑え、
たくさんの患者さんを苦痛から解放する一助になろうか?
筆者らは抗酸化剤を高分子化するというアイディアで、
これまでの欠点を補い、酸化ストレス障害に苦しむ患者のQOLを少しでも向上させることを願いつつ、本稿を閉じる。
謝 辞
レドックスポリマーは吉冨 徹博士(現東京大学)とともに始めたものである。
安全性や経口ナノメディシンではLong Binh Vong博士、静脈投与はPennapa Chonpathompikunlert博士、表面や材料設計は池田 豊博士、放射線保護はChitho P. Feliciano博士を中心に筑波大学長崎研究室のメンバーとともに研究を進めた。
また多くの共同研究者の方々にご助言、お手伝いいただいた。心より感謝申し上げます。
文 献
1) A. Abuchowski, J. R. McCoy, N. C. Palcuk, T. van Es, and F. F. Davis, J.Biol. Chem., 252, 3582 (1977)
2) http://enzon.com
3)池田 豊, Drug Delivery System, 31, 268 (2016)
4) Y. Matsumura and H. Maeda, Cancer Research, 46, 6387 (1986)
5) H. Maeda, M. Ueda, T. Morinaga, and T. Matsumoto, J. Med. Chem.,28, 455 (1985)
6)奥野修司, "がん治療革命「副作用のない抗がん剤」の誕生", 文藝春秋(2016)
7)吉川忠夫, "秦の始皇帝", 講談社学術文庫(2002)
8)たとえば日本抗加齢医学会(http://www.anti-aging.gr.jp)は設立15年目で会員数8,000人を超える大きな会に成長している
9)吉川敏一監修, 内藤裕仁, 豊國伸哉編集, "酸化ストレスの医学", 診断と治療社(2008)
10) G. Bjelakovic, et al., J. Am. Med. ASoc., 297, 842 (2007)
11) U. Theopold, Nature, 461, 486 (2009)
12) T. Yoshitomi, et al., Biomacromolecules, 10, 596 (2009)
13) L. B. Vong, et al., Mol. Pharmaceutics, 13, 3091 (2016)
14) T. Yoshitomi, et al., Biomaterials, 32, 8021 (2011)
15) A. Marushima, et al., Neurosurgery, 68, 1418 (2011)
16) L. B. Vong, et al., Biomaterials, 55, 54 (2015)
17) P. Chonpathonpikunlert, et al., PLoS ONE, 10, e0126013 (2015)
18) C. P. Feliciano, et al., Biomaterials, 129, 68 (2017)(10.1016/j.biomaterials.2017.03.011)
19) http://www.ims.tsukuba.ac.jp/~nagasaki_lab/data/170330nagasaki.pdf