出典:出典:前田 浩(故・前田浩先生(熊本大学名誉教授))Published: 2017-06-20 © 2017 公益社団法人日本農芸化学会 https://katosei.jsbba.or.jp/view_html.php?aid=826
はじめに
日本人の2人に1人は癌になり,3人に1人は癌で死ぬという厳しい現実があり,大きな問題となっている.癌遺伝子の発見など癌の先導的な分子生物学者である,MITのRobert Weinberg(ロバート・ワインバーグ)教授は,「癌研究において分子生物学こそが,この難問を解明する最高の手段だ」という確信のもと,雑誌「Cell」を40年前に創刊した.その御本人が,分子生物学的な手段だけでは癌の問題の解決には至らなかったと,自戒をこめた貴重な回顧論文を「Cell」の2014年3月号に発表している(1).
癌に罹患しない方策,発癌のメカニズムの解明,あるいは治療法の展開は,1970年代以来,多くの癌研究者(生化学,分子生物学,癌生物学,免疫学,あるいは病理学)や臨床家でさえも,遺伝子解析を中心とする分子生物学的アプローチにより,遠からず解決すると信じていた.しかしながら,癌の基本的な問題は何一つ解決できなかったことを,ワインバーグ教授は,上記論文で述懐している(1).その総説を中心に本稿ではわれわれが思いついた問題点も併せ論じたいと思う.
背景:古典病理腫瘍学から分子生物学へ
筆者の前田は大学院時代からほぼ半世紀にわたり制癌剤の研究に従事し,その間癌研究分野に出現した多くのセンセーショナルなトピックをつぶさに目撃した.それぞれのエポックメイキングな発見のたびに,メディア的にはこれで癌問題は解決できるとファンファーレが鳴り響いたのである.たとえば,癌ウイルスの発見,逆転写酵素の発見,オンコジーン(癌遺伝子)の発見,癌抑制遺伝子(P53)*1の発見,DNA修復メカニズム(遺伝子)の発見,ミサイル療法,分子標的薬,レセプター/シグナル/キナーゼ,VEGF,癌ワクチンなどの展開がそれである.最近ではチェックポイント阻害剤(オプジーボ®など)がそれである.
本稿の前半では分子生物学パラダイムと癌の多様性の立場から癌研究の問題点を,後半では制癌剤開発の立場から,分子遺伝学や分子標的型制癌剤開発に関して,実はそれらがほとんど失敗している事実をつまびらかにしたい.
1970年代の中ごろになると,当時の最先端な分子生物学,分子遺伝学,生化学の研究者にとって,古典的な病理学による癌研究は時代遅れと考えられていた.それゆえ,Cell誌の創刊は,これまでの癌研究の主流の形態学・病理学あるいは臨床医学的な手法よりも,分子生物学のパラダイムにより,解答が得られるとの期待が高まっていた.分子生物学者は要素還元論者(注;この場合はワトソン,クリックのDNA→タンパク質の流れに,生命現象のすべては基づくという考え,パラダイム)であり,癌細胞を分子生物学的に解析すれば癌の発生メカニズムや治療法の目途がつくであろうと考えられていた.伝統的な癌研究者が半世紀以上にもわたって蓄積してきた,解析不能と考えられていたこの混沌世界の問題に対して,分子生物学者は,癌細胞を最小単位の分子の詳細にまでふ分けして,分子レベルで,癌発生のメカニズムを普遍性のある知識として,理解できると考えていたのである.
「癌とは何か?」,「癌はどうやって発生するのか?」という基本的な問いに対し,当時新興してきた分子生物学的手法によって,癌研究者は画期的な解答を期待していた.今になって言えば,癌は単純な分子メカニズムで理解するにはあまりにも複雑であり,要素還元論の単純な考え方では理解できるものではないことがわかってきた.
そのような背景において,分子レベルによる癌研究に莫大な資金が投じられるようになったのは,1971年のニクソン大統領による国家プロジェクト「War on Cancer(対癌戦略)」であった.それは,癌ウイルスの感染によって,癌が引き起こされるという信念のもとに始められた.その癌ウイルスの研究途上で,このウイルスが逆転写酵素という驚くべき酵素を有していることを,ハワード・テミンとデイビッド・ボルチモアが独立して発見したことがきっかけである.ヒト癌の原因となるレトロウイルスに見いだされた逆転写酵素は,これまでのワトソン・クリックのDNA→RNA→タンパク質の普遍的な流れに対し,RNA→DNAという逆の流れをもたらし,癌化のメカニズムに重要な役割を占めているものと考えられた.DNAやRNAを遺伝子としてもつ多くのウイルスが,正常細胞に感染することで,トランスフォーム(試験管内の癌化)させることはよく知られていた(例,EBウイルス→ Bリンパ球のトランスフォーメーション).当時,ウイルスによる癌化は試験管内の培養細胞において見られた現象(注,トランスフォーメーションという不死化状態で,正常細胞と違って何代でも培養・増殖が可能となる)であるが,固体レベル(in vivo)において,いわゆる癌化が起こることは確認されていなかった.実際,シャーレの中で見られた現象というだけであった.
米国の対癌戦略War on Cancerとわが国の対がん10カ年戦略
わが国にあっても中曽根内閣で対がん10カ年計画が策定され,米国の時流の研究をフォローするように,癌重点研究や癌特別研究など中核的な研究者を班長として多くの班が組織され,その分野の研究は大きく進展した.当時の対癌戦略に携わっていた分子生物学関係者の主流は,逆転写酵素こそが癌化を理解するための重要な酵素であると信じていた.米国でも,わが国でも莫大な研究助成が与えられ,熾烈な競争が始まった.また,RNAウイルスのみならずDNAウイルスも癌を引き起こすことが明らかにされ,ポリオーマ,SV-40ウイルス,アデノウイルス,ヘルペスウイルスの研究者も癌研究に参戦した.後になって,上の仮説もアルプスの一つの峰で,とても癌全体を網羅できないことがわかってきた.
1970年代の終わり頃までには,ごく少数のウイルス学者を除いて,ヒト・レトロウイルスによる発癌に関して,ほとんど新たな知識はもっていなかった.そのため,真っ赤なうそとまでは言わないまでも,過度な喧伝によって,アメリカ議会を説き伏せ,対癌戦略を推し進めた人々に対し,無言の不平が蔓延していたが,研究は続けられた.それは,比較的小型のウイルス(ラウスサルコーマウイルス,RSV)が細胞に感染することにより,トランスフォーメーションという永続的な増殖状態に変換できる能力をもつという,単純・明確な事実があったためである.言い方を変えれば,癌のウイルス遺伝子の感染によってトランスフォーメーションが促されると考えたからである.
しかし,当時は癌が特定の遺伝子の病気だとする考え方は,推論に過ぎなかった.1975~1976年におけるバーマスとビショップによるsrc*2発癌遺伝子の発見はその考え方を変えることになる.彼らの研究は,レトロウイルスの遺伝子を相手のゲノムに組み込むことで,癌化することを明らかにした.この研究は,還元主義的な分子生物学の考え方と細胞のトランスフォーメーションという現象を結びつけたため,癌研究者の間にたいへんな興奮をもたらした.しかしながら,実はヒト癌とsrc癌遺伝子を一般的な臨床の癌に関連づけるのは難しかった.というのはヒト癌にsrcを見いだすことは不可能であったからである.
対癌戦略から10年が経ち,あまりめぼしい成果がなかったとはいえ,2つの重大な発見がもたらされた.一つは,高月清教授が発見したヒトの成人T細胞白血病(HTL)の研究成果で,その原因が,日沼瀬夫教授が発見した逆転写酵素をもつヒト・レトロウイルス(ヒトT細胞白血病ウイルス(HTLV))であることの証明であった.もう一つは,ほぼ同じころ,エイズ(AIDS)の原因が類似のレトロウイルスであることを,フランスのモンタニエらによってヒト免疫不全ウイルス(HIV)として明らかにされた事例である.
癌ウイルスと癌細胞の癌遺伝子の発見
1970年代の終わりには,バーマスとビショップの研究に感銘を受けたウイルス学者は,脊椎動物の遺伝子に存在するヒト癌遺伝子の発見へとつながる多くの癌原遺伝子(proto-oncogene)を明らかにし始めた.ワインバーグは,1973年にブルース・エイムス(カリフォルニア大学教授)によって報告された化学物質の変異原性(サルモネラ菌で検出する)と動物での発癌性の間には相関関係があるという研究に刺激を受けていた.この研究は,予想されるように,癌細胞は正常細胞から変異した細胞であること,外来性の遺伝ではなく,もともと細胞内に内在する遺伝子の変異によって癌化が起こることを強く示唆したものである.
以上の研究の流れから悪性細胞(癌細胞)の発生を引き起こすには複数の分子レベルのイベントの複合的な結果であることが明らかになってくるのである.それは思いもよらない複雑なシステムで,事はそう簡単ではないことを示唆していた.
1973年から,ワインバーグの研究室では,リン酸カルシウムによる遺伝子導入法(動物細胞への遺伝子導入法)を用いて,レトロウイルスの複製に関する研究を開始した.実際に,感染性のレトロウイルスの逆転写酵素より作成されたDNAを細胞内に遺伝子注入することで,天然の癌ウイルスと区別のつかない感染性のウイルス様粒子を作ることができたのである.同時に多くの研究者はトランスフォーメーションを起こす癌遺伝子を未感染の正常細胞に導入し,単層細胞がキラキラと光って見える細胞塊が出現する現象を認めていた.問題は変異原性発癌物質であるメチルコランスロリンの暴露によって形質転換した細胞内のDNAが,癌原性の情報をもっているかどうかである.しかも化学的にトランスフォームしたもので,レトロウイルスの感染履歴がないのにである.予想どおり1979年には,癌遺伝子導入や,化学物質によってトランスフォームした細胞にも,癌化のためのDNAの変異の情報が含まれていることがわかり,その3年後には,ワインバーグらによってヒト膀胱癌の癌遺伝子として単離されるに至るのである.癌細胞から単離した癌遺伝子を正常細胞に導入することによって,その正常細胞をトランスフォームすることができると思われた.
驚くべきことに,このヒト癌遺伝子は,数年前に癌ウイルス研究者が発見したras*3癌遺伝子のホモログであった.この結果は,もう一つの単純化理論の説明につながった.すなわち,哺乳動物細胞に存在する共通の癌原遺伝子(プロトオンコジーン,c-protoonc)が,微生物の感染や化学発癌物質の処理によって,活性化されるという明快な理論の構築に至るのである.
癌抑制遺伝子の発見
この発癌メカニズムはさらに単純明快に現実のものになった.すなわち膀胱癌で見つかった癌遺伝子の遺伝子配列は,プロトオンコジーンとは,たった1カ所の塩基配列の変異によるものであった.つまり1982年の僅かな間には,極端に単純化して言えば,癌とは30億塩基対のうちのたった一つの塩基対の違いによって,生ずることがわかった.このような状況から,要素還元論者の目から見ると,あと30年もしないで,癌の問題は解決されると考えていた.しかしながら,ras癌遺伝子が点突然変異であると報告がなされるやいなや,数週間のうちに,癌はそう単純ではないと主張する人たちが現れてきた.ヒト癌の発生に関する生物学的研究をしていたJohn Cairns(ジョン・カーンズ)は,統計論的にみると稀にしか起こらない癌遺伝子の変異(一塩基対変異)では,ヒト癌の複雑さは説明できないと主張した.確かに,マウスでは癌原遺伝子の変異を必須とする段階はあまり多くないようであった.事実,1983年には,共役した2つの遺伝子の変異だけで,正常細胞を完全に癌化できることが報告された.しかし,この考え方でさえも幻想であることが,数年後にはわかってきた.げっ歯類の細胞を用いた実験においては,2つの遺伝子の変異のみで癌化を誘導できたのだが,実験的にトランスフォームするのが困難なことが知られているヒト細胞ではなかなかうまくいかず,5つもしくはそれ以上の遺伝子の変異が必要であった.このことは,遺伝子を標的とする分子標的薬の開発に対して大きな示唆を与えるものである.
つまり,細胞の癌化には複数の遺伝子変異が重要であり,それが癌原遺伝子に起こっているのか,癌抑制遺伝子に起こっているのかということである.癌抑制遺伝子の損傷による発癌説を提唱する先駆者は,1980年代後半には数多くの癌原遺伝子の発見が見られ,発癌現象の単純統一化は困難であり,癌遺伝子熱は冷ややかに見られた.このカーンズのような有名教授の意見に対して,ワインバーグも同意しているのである.
癌遺伝子と癌抑制遺伝子という両クラスの遺伝子が重要であることは,大腸癌の病理組織学的ステージと,ある遺伝子群の組み合わせの変化が関連していることからも予想させられたが,1989年になってVogelstein(ヴォーゲルスタイン)教授(Johns Hopkin大学のヒト遺伝子の大家)や,Gerlinger(英国のガーリンジャー)らの一連の研究から明らかになった*4).白血病や軟部組織の腫瘍では1桁台の変異数と少ないが,大腸癌や胃癌も数十を下らない(3, 4).ヴォーゲルスタイン教授らの論文の1年前にガーリンジャー氏らは同一腎癌症例の遺伝子をさらに詳細に検討し,転移の先々において,もととは違った遺伝子多形がおびただしく生じていることを証明している(2).したがって,いわゆる分子標的薬や癌ワクチンによる治療の有効性が乏しいことは,これらのデータから容易に予想される.それにもかかわらず,分子標的薬や癌ワクチンの開発に巨億の税金が投じられている.以上のように,ヒトの癌の遺伝子の多様性が無数にあることを考えると,現実の癌遺伝子が不変であるとの作業仮説に基づく分子標的薬の開発のような遺伝子が永遠に不変などということは,ありえないのである.したがって,対癌戦略は根本的に戦略が間違っていることに気づかなければならない.この点に関して,文献5のリーフ氏の9年にわたる詳細かつ探求的で圧倒的な内容の著書を参考にされたい.,(2~4).その結果,癌の進展(progression)の程度が進めば進むほど,癌原遺伝子や体細胞遺伝子の変異がより多く見られたのである.そのため,癌原遺伝子も癌抑制遺伝子も,癌形成には重要であり,しかもどちらも癌細胞の中にもともと共存しているものなのである(2~4).
癌化のプロセスと遺伝子変異のランダム性・多様性
癌の進展における各遺伝子発現の流れを考える研究者は,ヒト大腸癌の発生には,ある遺伝子群の特定の塩基配列の変異が重要であると考えた.当初は,大腸癌の発生において,初期の段階にAPC遺伝子変異が起こり,ついでK-rasやp53に変異が起こりやすいという蓋然性しか明らかになっていなかった.しかし実際は,遺伝子変異が起こる順番は決まっていないこと,症例ごとに異なること,さらに多くの大腸癌においては,K-ras遺伝子に変異が見られないことも明らかになってきた.実際に,大腸癌の発生においては,ランダムに遺伝子変異が起こっており,規則性はなく,ある場合にはras癌遺伝子さえも変わらないこともあり,大腸癌の発生・増殖と遺伝子変異の関係性をひも解くことは非常に難しい問題であることがわかってきた.むしろ,それぞれが癌において遺伝子変異の種類・順番に決まりはなく,それぞれ個別のものだと考えられた.このような状況にもかかわらず,ワインバーグらは,1999年には,癌の遺伝的な現象論に規則性があるはずだと考えていた.つまり,それぞれの癌は常に個性の異なる顔をしているように見えても,その根幹に何か共通点があるはずだと彼は考えていたのだ.すなわち,癌細胞は限られた表現形質と細胞内信号回路をもつ違いのみであると理由づけしていた.原則として,その共通性を摘出するためには,すべてとは言わないまでも,多くの癌細胞において破綻しているシグナル経路を見つけ出すことである.しかしながら,当時も,またその15年後の今でも,断片的にしかこれらの細胞内のシグナル回路を理解できていないと述べている(1, 5).
感染と炎症によるラジカル生成と変異原性の活性化
筆者(前田)らは1980年代後半にインフルエンザウイルスによる肺炎の原因をマウスのモデルで解析していた(6).われわれの興味はこの肺炎でマウスを死に至らしめている病原因子(分子)は何かということである.つまり,分子生物学的証拠の裏づけによって,病原分子(物質)を見極めるための研究である.そのマウスを死に至らしめるウイルス性肺炎において,ウイルスそのものが病死の原因であれば,肺のウイルス量は致死的になるほど増加し,死期に至って最高値になるはずであった.微生物学における最も基本的な「コッホの原理」で言えば,もしある病気の原因が,ある特定のウイルスであれば,その同じウイルスがその感染局所から必ず発見(同定)されるはずである.しかし,驚いたことに,われわれのインフルエンザウイルス感染症モデル(マウス)の肺の局所を調べてみると,感染直後からウイルス量は漸増してくるが,死に至る極期にはウイルスは発見されないのである.それでは何がウイルスを殺した犯人(病原分子)かという謎が残った*5.
われわれは多面的に分子レベルで検討した結果,肺胞中に活性酸素(O2・−)の過剰産生(正常の200~600倍も)が起こっていることを発見した.後に一酸化窒素(NO)という単純な分子も同時に過剰生成していることも見いだした(7, 8).さらにこのO2・−とNOが同時に存在するとラジカル・ラジカル反応でNO+O2・−→ONOO−(パーオキシナイトライト)が生じ,特にONOO−が生体内のvital分子(DNA, RNA,タンパク質,脂質など)と瞬時に反応し,細胞の死滅,DNAまたはRNAの切断,ニトロ化,酸化,当然のことながら変異も引き起こすことがわかったのである(9, 10).
この研究は一部のオンコジーン研究者の注目を引くに至っているが,変異→核酸の傷害→オンコジーン活性化→癌抑制遺伝子の抑制→発癌につながることであり,上記の活性酸素分子(ROS*6)はおおむねランダムにDNAあるいはRNA上の標的分子(残基)と反応する(図1).
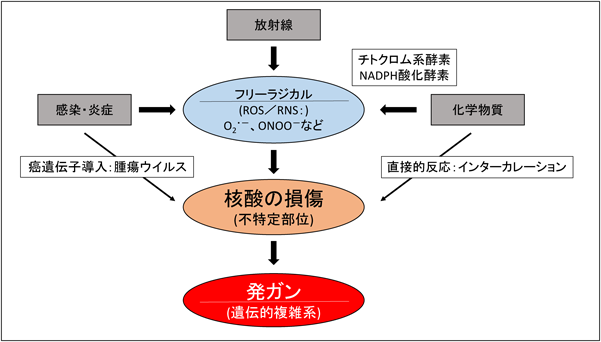
図1■発癌の三位一体説
化学発癌,放射線発癌,感染症による発癌における共通分子としてのフリーラジカル
以上のウイルス感染によるROSの生成の発見は,慢性感染(炎症)による発癌メカニズムに強い示唆を与えるものである.たとえば,ピロリ菌感染(→胃癌),肝炎ウイルス感染(→肝癌)はよく知られている.慢性膵炎,慢性胆のう炎(→膵癌,胆のう癌)も同様であろう.ピロリ菌も肝炎ウイルスもいわゆる癌遺伝子をもっていない.このような炎症性のラジカル生成によるDNAの損傷が,抑制遺伝子や,癌原遺伝子が生ずれば,炎症性・感染性発癌からのラジカル生成を介した発癌メカニズムの説明として最も可能性があるものだと考えている(図1).
複雑系としての癌の本質から単純系を求めて
ワインバーグらは癌細胞の複雑さの中にも,何か単純な規則性が隠されているのではないかと考え,複雑なシグナル伝達系ではなく,腫瘍組織の形態発現(phenotypes)の生物学的研究に焦点を当てた研究を行い,その研究結果を取り急ぎまとめたレビューを投稿した(11).その論文は癌研究に携わる多くの研究者にはあまりにも単純すぎ,世間の反響なく,広く受け入れられないだろうと思っていたが,10年後になってみると,それは間違いであったことに気づいた.つまり,混乱を極めている癌研究に携わる多くの研究者にとっては大きな助け舟になったようである.この10年間に,何千もの論文でそのレビューは引用されたという.
ワインバーグらはその10年後の2011年に,再び多くのヒト癌がどのように発生するかを明らかにするために,癌発生の予徴となる現象を見直し,癌発生のメカニズムをさらに単純化した論文を発表した(12).癌の特徴はいろいろあるが,それまでの6種類から8種類の特徴を明らかにした.それでも,全体像は霧に覆われていた.
さらにまた,癌の浸潤や転移の生物学的プロセスはより,一段と研究が進んでいる分野の一つであるが,その点でも少数の普遍性を求めた研究がなされており,癌細胞は原発巣から転移巣に移動する際には,比較的少数の共通メカニズムを利用していることがわかってきた.その法則性も少しずつわかってきたようにみえるが(13),現実はそう簡単なものではなかった.癌細胞が原発巣から多臓器に転移しても,その組織環境は癌細胞にとって増殖しにくい環境であることが多い.それは,癌患者にとっては喜ばしいことなのではあるが,癌細胞が転移先の微小環境に適応し増殖することは非常に困難なことであり,その適応メカニズムを簡単に説明することは難しいことである.サンディエゴのRobert Hoffman(ロバート・ホフマン)教授は実験に用いるマウスの移植腫瘍の,そのもとの癌の発生部位と人工的に移植する部位が同一であることはほとんどなく,たとえば,肝臓癌や腎臓癌細胞を背部皮下に移植したとすると,その場の血管の走行や酸素分圧,そのほかの微小環境は大きく異なっており,そこで増殖する癌の結果をヒトにそのまま応用(期待)するには無理があるという.
2000年頃から,癌に関する膨大なデータが今やルーチンに解析できるようになった.一日のうちに数多くのDNAの発現アレイ分析を,何千もの癌の,何千もの癌遺伝子の発現を解析することができるようになり,個々の癌細胞のおびただしい変異遺伝子が明らかになってきた.
またタンパク質を例にとると,2つの相互作用する成分のあるタンパク質が,ある生物学的プロセスにとって決定的であるとしても,2,000ものタンパク質をインタラクトーム解析することでどれだけの情報が得られるのかを想像してほしい.かくして私たちは無意識のうちに,莫大な情報を扱う「オミックス」の時代に突入している.(オミックス;ゲノミックス,トランスクリプトミックス,プロテオミックス,エピジェノミックス,キノミックス,メチローム,グリコーム,マトリソームの総称).その一つひとつが呆然とするほどの膨大な情報を含んでいる.このように,膨大なデータ(いわゆるビッグデータ)を比較的容易に入手できるため,その手法はやめられない魅力があり,強力な研究ツールとなったのである.
現在の先端的な癌生物学,癌遺伝子学,癌免疫学の専門家の考えとして,癌の複雑なシステムを理解するには,すべての動きのある部分も遺伝子の多様性としてひとまとまりにして概観するような包括的な解析法を用いることで,癌細胞・癌組織を含めた,複雑な生物システムを明らかにできると考えている.確かにその手法はより深い洞察を与えてくれるかもしれないが,今必要とされるのは,—このドクトリンに従えば—コンピューターによるアルゴリズム解析で,そこからデータを単純化し,明日への示唆が得られ,たとえば癌の発生メカニズムや治療薬の作用メカニズムなどのより複雑な事象が,どのように生じているかが明らかになろうということである.
これは40年前にワインバーグら分子生物学者のもっていた過度の自信と同様のものが,物理学者,数学者,生物情報学者たちからも,垣間見える.これに対してワインバーグは今になって「癌とは何と複雑なものなのか!」と実感しているという.
稀に,非常に興味深い遺伝子やタンパク質が見つかったとしても,すべての癌細胞の挙動を理解するには程遠い状況にある.バイオインフォーマティクスの有効例として,ある研究者は,発現アレイ解析と病気の診断と予後の相関性を示した.しかし,異なる2人の乳癌患者の発現アレイ解析をすることで,それぞれの患者の予後の予測には貢献したが,2人の患者の間で,共通の遺伝子やタンパク質はほとんど見つからなかった.このことも,得られた膨大な情報と癌の生物学の理解には大きな隔たりがあることを物語っている.
このような考え方は広く世界に浸透し,この膨大なビッグデータを用いれば個々の患者に最適な治療法が確立できると考えられ,事実,筆者の友人(医学部教授)は,この方向の癌治療の楽観説を講義している.最近のNHKの特集番組のプレシジョンメディシン(変異のある個々のDNA配列に対応した制癌剤を開発するという手法)も,同一患者内におびただしい変異株があることを無視している.一方,ヴォーゲルスタインの有名な最近のレビューによれば,同じ肺癌患者の転移巣の癌も300種くらいのDNA変異があるという(2, 4)(表1).そうなると,その各々の変異株に対する分子標的薬剤や抗体医薬を製造することは実用的には不可能であろう.

分子標的薬もその患者も標的分子が変わらなければよい訳であるが,10年も30年もかかって成立した癌では変異株(標的の脱落したもの)が多様化するのは当然である.これに対して,炎症とか宿主反応(免疫)のない同系統のマウスの癌を用いた単一純粋なクローンの癌細胞系モデルにおいては,変異株はほとんど生じない.その系でいくら効果があっても100倍も300倍も遺伝子に多様性があれば100に一つでも効けばよいほうで,まず効かないといえる.現実の臨床からの各種報告は,それを裏づけている.オプジーボ®でさえも8割の患者には無効であると言われている.しかし,現時点で有効性をみている患者さんにおいては,自己免疫病という副作用がないことを祈り,そのうち完全治癒になることを期待したい.
分子標的薬ならびに抗体医薬等の理論的矛盾:癌細胞の多様化の進行に対応する困難さ
感染炎症において生成するROSによる核酸への傷害は容易に細胞の変異を引き起こすことは前述したが,それに対し,古くから知られている化学発癌剤による発癌メカニズムも再検討を要する.古くはDNAとベンズピレンなどのインターカレーションによって引き起こされるDNA複製阻害は単純にDNA合成阻害や変異をもたらすであろうことは理解できるが,クロロホルムやベンゼンあるいはヘテロサイクリックアミンは必ずしもそれで説明がつかない.変異原性試験(変異原性物質の検出)には,いわゆるAmesテストと言われるアッセイ系においては肝臓のホモゲネートのミクロゾームS9フラクションをアッセイ系に加えている.この系は実はP450などチトクロム,チトクロムb5還元酵素などを含んでおり,そこにはNO合成酵素(アルギニン→NO)とP450酸化酵素によるスーパーオキサイド(O2・−)の生成が随伴する.生じた,ONOO−, ROS/RNS*7によってグアニンのニトロ化が最も速く進行する.またニトログアニンはNO合成酵素やチトクロムb5還元酵素によってスーパーオキサイドを生成する.この反応は図2に示すような増殖反応で,酸素の供給が十分あれば1分子の基質から何分子ものスーパーオキサイドを生成する増殖性の反応である(レドックスサイクリング).ヘテロサイクリックアミンやニトログアニン,その他の化合物がこの反応を同様に誘発するのである.したがって感染・炎症反応も化学発癌もROSという共通変異原物質(その多くは発癌物質)と共通項をもっていることを,われわれは明らかにしている(14)(図1, 2).
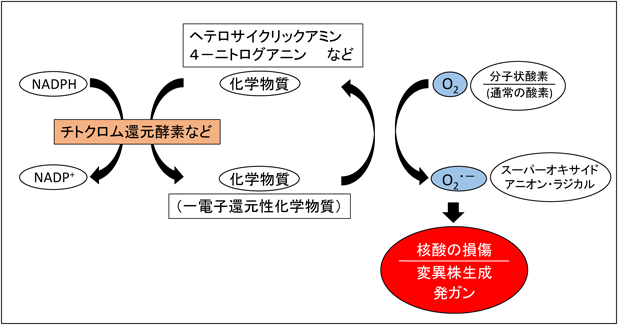
図2■化学発癌物質を介した,活性酸素の生成と発癌機構.文献14より改変.
分子標的薬の代表的な例として,VEGF(血管内皮細胞増殖因子)を標的とする薬剤が数多く知られており,乳癌や肺癌,そのほかの治療戦略に用いられている(15, 16).この最も期待されたVEGF/R(レセプター)を標的とする分子標的薬も後述するように,現実の臨床応用に試みた結果は無残な結果といえる(p. 507左段)。その理由は内因的に癌組織(細胞)に生じている遺伝子変異という避け難い要因があるからである(2~4).
後述のように次の問題として,多段階発癌には厄介な問題がある.癌は変遷する標的であり,増殖(progression)のある段階での相互作用は次の段階になると違ってくるものである.また,それに加えて個々の癌細胞のおかれた微小環境の違いがある.そのため,個々の癌発生において多面的に解析を行うことが,発癌の理解に重要である.ある一つの癌の一つの増殖段階だけをみても,そこには全く新しい次元の複雑さが隠れている(たとえばワインバーグの癌細胞の増殖シグナリングのマップを見ればわかる[ワインバーグ著書Cancer Geneの付録の図].それは,癌組織における詳細でより深いDNA解析からわかったことであるが,同じ癌組織の癌細胞中にも異なる段階の増殖形態から,全く異なる挙動を示すものがあることである.そのような「システムバイオロジー」という考え方でデータ処理を行おうとする試みが続けられているが,癌の生物学に関して,有用な結果は僅かしか得られていない.観察された情報と生物学的な考察が,乖離しているとまでは言わないまでも,ずれている状況にあるからである.
ワインバーグは次のように述べている.「1980~2000年頃も2010~2015年はなおさら,癌の研究上の膨大なデータを入手しているが,癌の発生のメカニズムについて,ほんの僅かしかわかっていない.分子生物学や腫瘍遺伝学をもってすれば,細胞の癌化メカニズムをその構成要素に分解・単純化して還元論的に理解できると考えていたが,その膨大なデータを得た現在も,再び同様の葛藤の中にある.繰り返していえばわれわれは収集した癌に関するデータの多くは,真の意味で消化し,解釈しきっているとは言いきれない.われわれは再び原点に回帰しているのかもしれない.どうやってこの問題を終わらせるのか? 私には知る由もない.次世代の研究者が決めることである.このような波乱万丈の経験はともかく,私は私のできることを続けていくのみだ」.
たとえばFortune(フォーチュン)誌の編集長を永年にわたり歴任し,ご自身も癌患者としての苦難を克服し,癌の問題にたいへん詳しいClifton Leaf(クリフトン・リーフ)氏は自分の著書“The Truth in Small Doses”(Simon & Schuster社,NY, 2013)の13章,p. 283(下から7L-2L)中で次のように述べている(5).すなわち, 癌の分子生物学的研究でP53という癌抑制遺伝子の研究は,一つの大きなはやりになっていた.「その研究に米国では,65億ドルをかけ,6万5千報の研究論文が報告されている.論文当たり邦貨で約1,200万円もかけている.しかしながら,このようなはやりの一点集中的研究投資から,癌治療薬の新しい扉も見つかっていないし,何ら新しい癌治療薬が生まれたとは誰も思っていないし,さらにまたP53関係の癌の診断薬もない」.一方,イマニチブ(グリベリック®)やシスプラチン®の発見さえも思いつき,セレンディピティと「勘」で成功したものであることが知られている(後述).
分子標的薬のコンセプト以来20~30年経過し,それに基づく数多くの薬剤が臨床で試みられている.その最も有名なものの一つが前述のVEGF(血管内皮細胞増殖因子)の抗体,ベバシツマブ(アバスチン®,ロシュ社)やそのレセプターの抗体薬である.そのうちでも患者数の多い乳癌,大腸癌,肺癌,腎癌に対する評価がその一つであり,それ以外にもこの分子標的薬が無効の例はいくつもあるが,最近の例として前述の前立腺癌の第三段目の治療戦略に耐性前立腺癌の骨転移癌に対する効果でも無効の判定をされている.前述のようにJ. Clin. Oncol.誌という権威ある雑誌に,“抗VEGF療法の乳癌治療法:Game Over?勝負はあった”つまり無効判定となったというショッキングなタイトルで記している(17, 18).同様のヒト化VEGF抗体ベバシツマブも効果は初期の報告ほどではないという.このように分子標的薬に対する類似の報告例は近年おびただしい.
分子標的薬の開発コンセプトの定義は,まずはじめに標的分子構造が明らかであって,それに基づいて拮抗分子Antidote(拮抗する物質)を設計することである.その最初の例がグリベリック®である.すなわち,特定のチロシンキナーゼの活性部位の構造にフィットするような化合物を設計し,それをノバルティス社で合成に成功したことに始まるといわれている.この話はイマニチブが慢性骨髄性白血病に著効を示したあとのつじつま合わせの話で,リーフ氏の著書に詳しい(5).また,それに至るセレンディピティや多くの先覚者の知識が本当は無視され語られていないからである.この論旨は,次世代21世紀の創薬はすべて標的分子の構造解析をしたうえでの分子標的薬の開発を進めるべきだとの話に世界の多くの創薬従事者は洗脳され,わが国においても,そのような手法で開発した分子標的薬でなければ分子標的薬の仲間に入れてもらえない,と言われるような雰囲気になっていた.しかしながら,リーフ氏のように現実を冷徹に見通す人は,上記の分子標的薬のコンセプトのために世界の新薬開発は10~20年は遅れたという.つまり,それが間違いだと人々が気づくのに10年はかかるということであった.ノーベル賞の大村 智先生もこの考えに同感で,大村先生の発見したスタウロスポリンもグリベック®の展開に貢献していることは無視されているという.リーフ氏は上記のノバルティス社の分子標的薬の設計に基づく薬が本当の分子標的薬で,ペニシリンやアスピリンの標的分子は今ではよく知られているが,これらは分子標的薬の定義に入らないのである.
もともと分子標的薬の臨床におけるセールスポイントは,癌,リューマチ/炎症などに特異的な分子とのみ反応しその分子を不活性化するので,正常で健常な臓器には作用しないということである.これは特に制癌剤のような毒性の強い薬剤では重要なポイントである.しかし,人間の浅知恵に基づく標的分子は予想された分子標的あるいは,考えている作用機序以外に作用点がある可能性が充分あるということである.世界でも最大手の製薬企業の米国のメルク社(MSDともいう)およびファイザー社とも抗炎症剤のチャンピオンになると開発した分子標的薬が,意外や心筋梗塞などの副作用を引き起こすなど,多くの重篤な被害者が出たことにより,承認取り消しを経験している.さらにまた分子標的薬も結構シビアな副作用(肺線維症など)があり,それが治療法のない進行性の副作用である場合は,患者も臨床家も苦難に直面するという現実も結構論じられている.
固型癌のDDS*8と普遍的ターゲットを求めて:癌の特性とEPR効果*9の利用
以上の内容はいずれも癌という複雑系を有する生物に普遍的な分子生物学レベルでの共通の攻撃目標はないということになる.DDSの研究者も同様に,過去20~30年にわたって,抗癌剤を癌に選択的にデリバーしようとその方策を探してきた訳であり,これは大切な命題である.この点に関し,固型癌組織と正常組織にはいくつかの大きな普遍的かつ特徴的な違いがあり,特に血管の構造が前者は粗雑で,低分子はもちろん高分子物質までも容易に漏出し,しかもリンパ系(高分子や脂肪球を除去するための下水路系に相当)の機能不全のためいったん組織中に漏出した高分子物質の場合は,それがそこに長期間にわたり未回収のまま残留することをわれわれは1986年に発見し,これをEPR効果(enhanced permeabilited retention effect)と命名した[腫瘍特異的現象(i)](18).つまり,高分子,ナノメディシン,タンパク製剤,リポゾームやミセル製剤などの高分子薬剤は,静脈注射後数時間~50時間以上かけて腫瘍部に高濃度に集積し,そこに長時間にわたり高濃度に残留する.一方,正常組織ではEPR効果は見られず,したがって,高分子薬物の蓄積がないので毒性も発現しない.万一そこにデリバーされても,リンパ系から回収除去されるわけである.このわれわれのEPR効果の発見に対して2016年のトムソン・ロイター社のWeb-of-Science化学部門の最多被引用のベスト3となり,栄誉賞にあずかっている.(それがノーベル賞予測に用いられ,今年はそれに対してわが国から,われわれ共著者2名であった.)
さらに,in vivoの組織内のpHは,癌と正常部組織で違いがあり,すなわち, 癌組織のpH 6.0~6.5に対し,正常組織はpH 7.4で,[H+]濃度で約10倍も違う.ヒドラゾン結合を介した結合薬物などではこの酸性pHで容易に加水分解により切断され低分子のもとの薬物が放出される.その結果,分子量の差で数千倍の差となることで拡散係数(範囲)が100倍も大きくなり,組織の浸透拡散移動が容易となる.さらにまた,局所のpHの差に加えて,第2の違いは,癌組織と正常組織との違いとして,腫瘍部では多くの加水分解酵素プロテアーゼ(コラゲナーゼ,カテプシンB,エステラーゼ)などが生成されており,ポリマーと薬物をつなぐリンカーがこれらの基質に適合する構造を含有すれば,低分子の薬物はより早く切断放出される.つまり,正常部と異なる薬物の挙動に基づき抗腫瘍活性を示すことになる[腫瘍特異的現象(ii)].
腫瘍特異的現象の(iii)としてわれわれは多くの腫瘍細胞に高発現している細胞膜上のトランスポーターを重要視している.たとえばグルコーストランスポーターは癌の診断のペット(positron emission tomography)において,グルコースの誘導体のフロロデオキシグルコース(FDG)はよく知られている.これは低分子であり,グルコールトランスポーターにより腫瘍細胞に急速に取り込まれるが,FDGは数時間後には減弱消失する.同様のことがアミノ酸や核酸の細胞内取り込みの亢進にも見られる.ピラルビシンはドキソルビシンにピラニル基を付加しただけで癌細胞への取り込みが50~100倍も上昇する.このような点を利用する工夫はcellレベルでの癌の特異性を利用したわれわれのポリマー結合ピラルビシン(P-THP)には見られる(19).
この延長線上の話題として,EPR効果により,ナノ粒子化した薬物,たとえばナノ化蛍光色素,ナノ化光増感剤,あるいはナノ化硼素剤などは,いずれも固型腫瘍選択的に集積し,固型癌の高感度蛍光検出(診断),光照射療法(PDT*10),熱中性子捕獲療法(BNCT*11)などの癌の診断と治療に画期的な貢献が期待できる.この項に取り上げた問題はワインバーグの述べたいわゆる分子生物学的アプローチではないが,われわれはヴォーゲルスタインの述べる癌のおびただしい変異株,不均一性に対してもin vivoのレベルでEPR効果を中心に癌組織普遍的に対処できると考えている(20, 21).
おわりに
今や人類共通の敵である癌に対する対策は,あらゆる観点を見据えて進めるべきで,特定のパラダイムにとらわれない,想定外の事象内にも解決策の可能性があることを真摯に検討すべきであろう.一つの油田を発見しても,同じ油田を10倍,100倍深く掘ってもその油の産出量は限られている.別のシステムにも石油に劣らない可能性が潜んでいることを思うべきである.かつてゼロ戦が空中戦において勝つために,パイロットは,自分の戦闘機の優秀性に加え,敵機を上下左右360度方向に目を見張らなければ勝ち目がないとの言葉を残している(22).研究においても,特に難敵である癌の制圧においては,的を得ている言葉だと言える(22).この癌の問題の一般向けの解説書として文献23と24が勧められる.