🔳mRNAの立ち位置
■mRNA 癌ワクチンの開発動向
世界初の「がんワクチン」を開発しているのはドイツのバイオ企業「ビオンテック」。
新型コロナウイルスのワクチンをファイザー社と共に開発したことで知られている。
◇独・ビオンテック ウール・シャヒンCEO、オズレム・テュレジCMOがBBC番組(2022年10月)での発言
⇒「私たちが『がんワクチン』開発のために何十年も研究してきたことが、
⇒新型コロナワクチン開発の追い風になりました。
⇒そして今、その開発で培った経験ががん研究に活かされています。
⇒がんの治療用ワクチンは2030年までに広く利用できるようになるでしょう。
◇独・ビオンテック カタリン・カリコ上級副社長
・ある種の肝臓疾患や心臓疾患の治療にもなり
⇒メッセンジャーRNAがとても多くの異なる用途や他の病気に使われるようになるでしょう。
■mRNA技術の応用で開ける世界(mRNA 癌ワクチン)
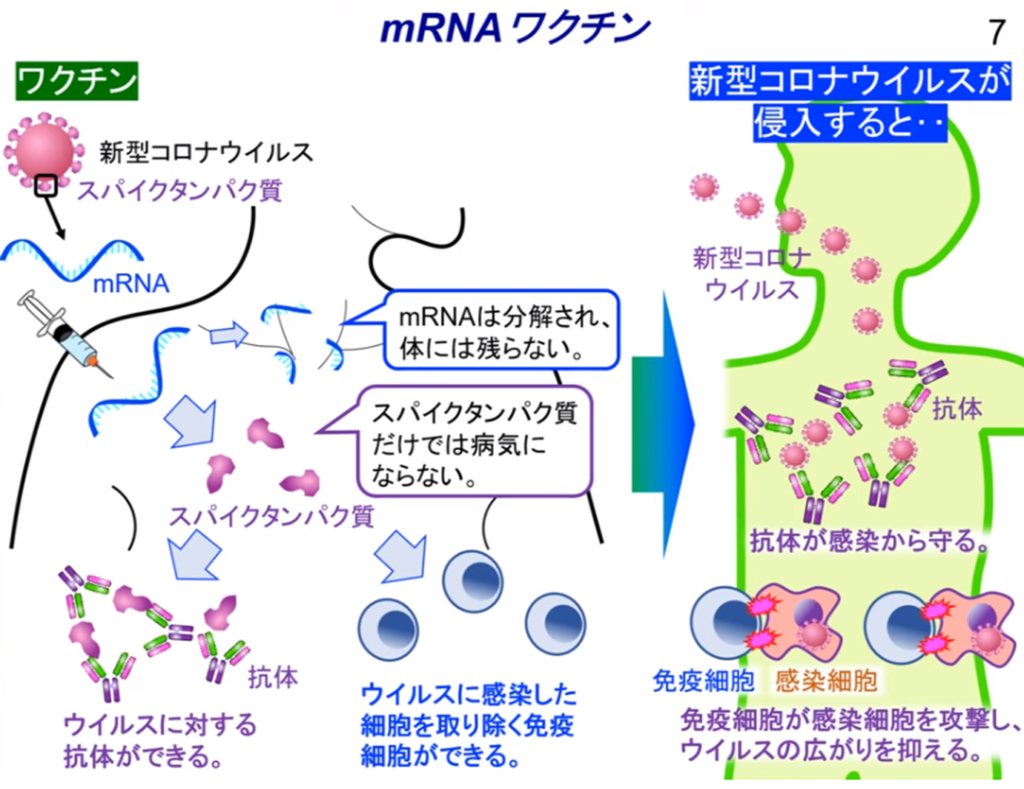
◆新型コロナウイルス感染予防と重症化予防としてのmRNAワクチン
~スパイクタンパク質の遺伝子の複製(mRNA)とキラーT細胞の誘導~
・体内に注入(筋肉注射)されたmRNA(=スパイクタンパク質)により
⇒B細胞から抗体を生成(感染予防)。
・免疫機構を活用してキラーT細胞を効果的に誘導(重症化予防)
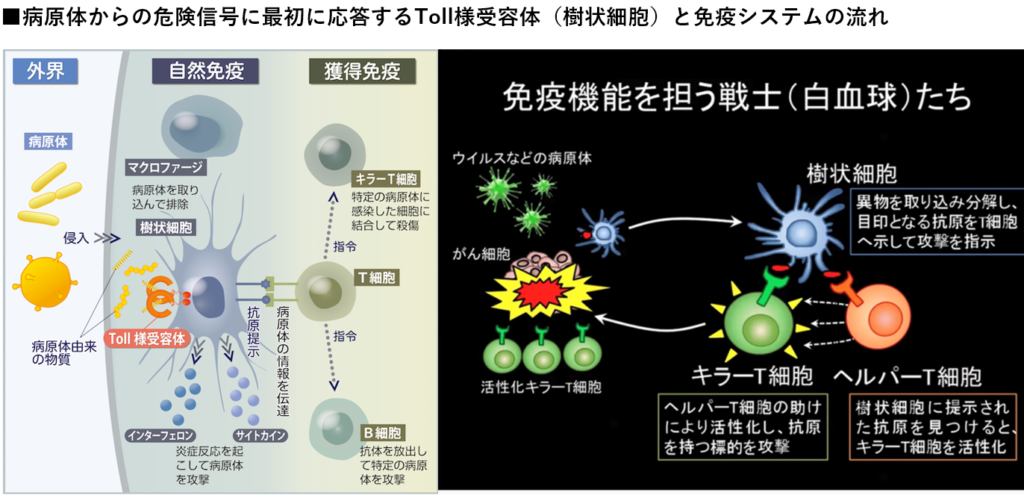
⇒ウイルス等の異物が体内にいるかをパトロールする樹状細胞と異物を攻撃するT細胞
・樹状細胞
⇒ウイルス等の異物を取込み、分解し、抗原をヘルパーT細胞に提示
・ヘルパーT細胞
⇒抗原を見つけるとキラーT細胞を活性化(抗原を連絡する)させる。
・キラーT細胞
⇒抗原を持つ標的(ウイルス等)を攻撃し、破壊する。
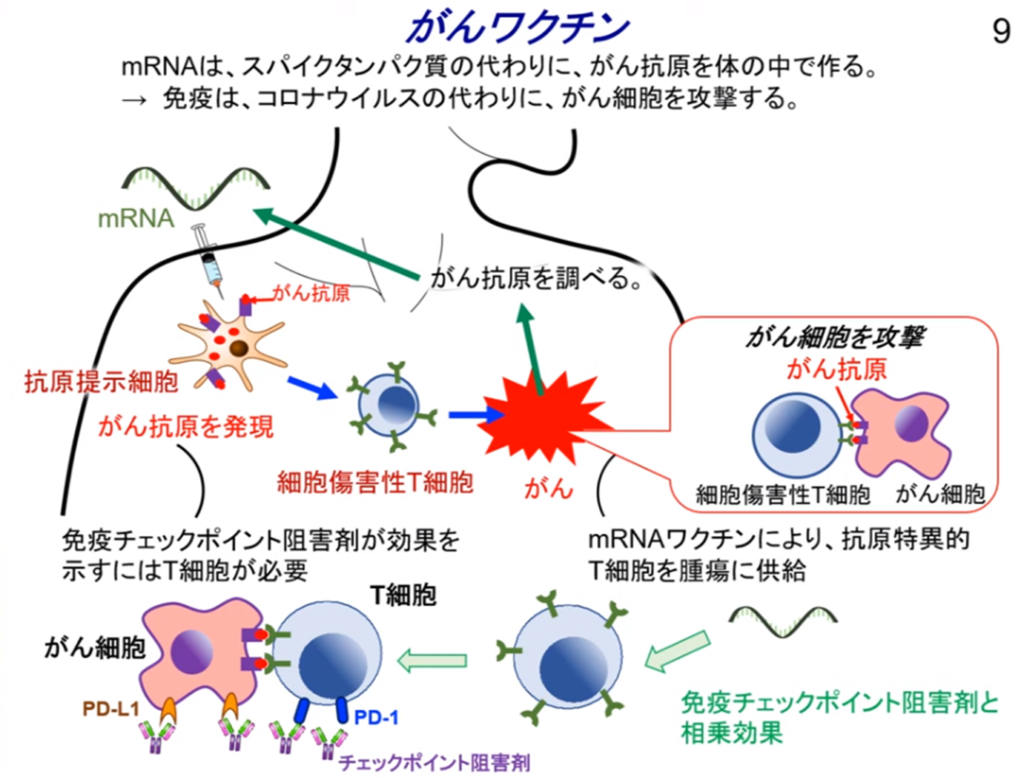
◆癌ワクチン
・体内に注射されたmRNA(=癌抗原)を目印に
⇒キラーT細胞を効果的に誘導して癌細胞を攻撃・破壊する。
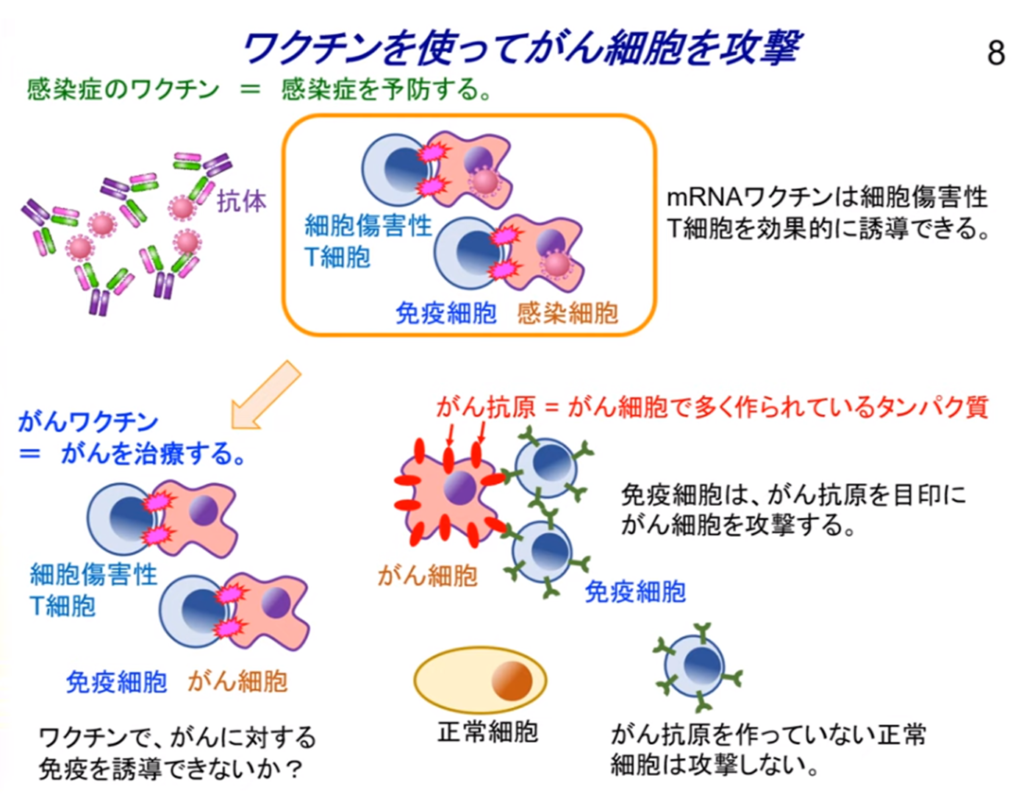
◆「ワクチン」といってもがんを予防するものではなく、がんを治療するためのもの。
・患者ごとにつくる「オーダーメイドワクチン」
⇒患者ごとに最も効果が期待できるように作れる。
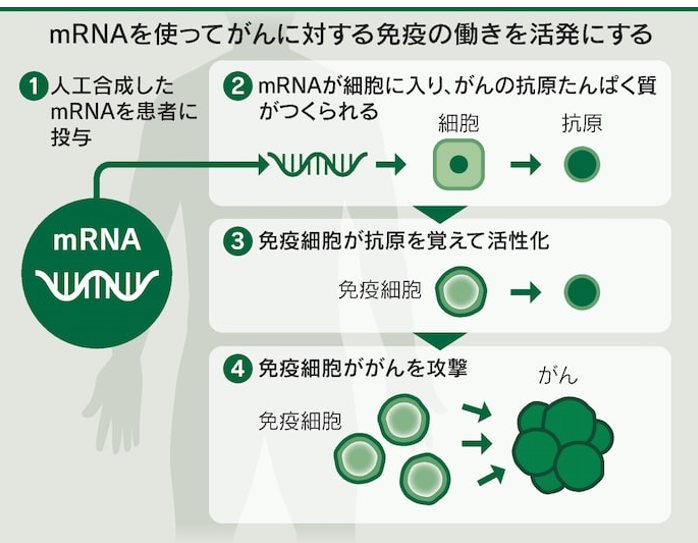
・メッセンジャーRNA
⇒たんぱく質の設計図
⇒その情報の部分はいくらでも書き換えられる。
⇒患者のがん組織を直接とって、その異常な部分を調べて、
⇒それに対するワクチンを1人1人に設計して、それをメッセンジャーRNAの形で投与する。
⇒この細胞は敵だぞ、やっつける相手だぞという風に体の免疫システムに認識させて治療に役立てる」
⇒『個別化医療』という時代(21世紀を実感させる)の幕開けを予感させる。
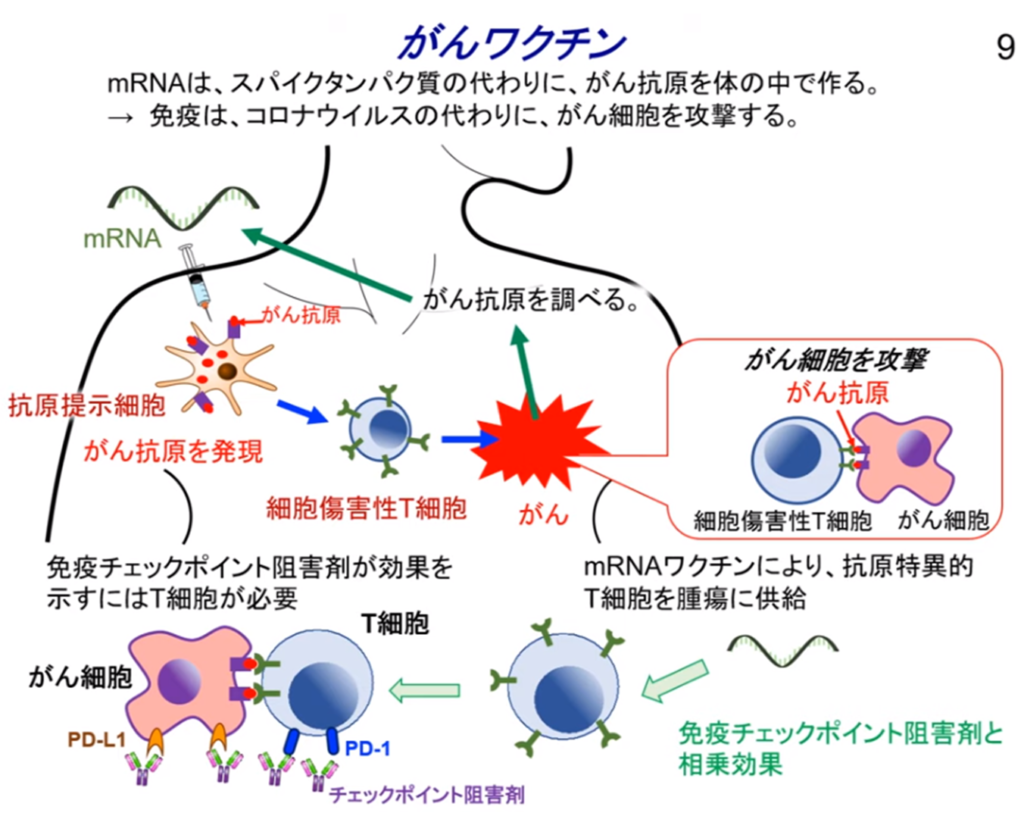
◆免疫療法とmRNAがんワクチンの研究
・多くの相乗効果がある。
⇒癌ワクチンは免疫チェックポイント阻害薬(オプジーボ等)の成功をもとに成り立っており
⇒その基礎となる生物学の知識を広げる。
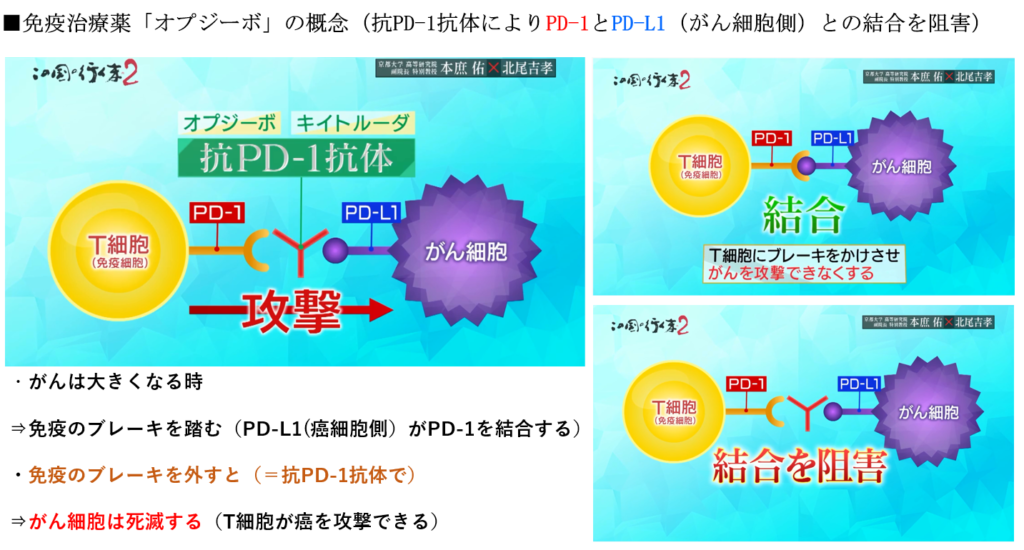
■PD-1阻害療法によるがん治療のパラダイムシフト
・従来の免疫治療はアクセルのみに焦点を当てた開発しか出来なかった。
⇒そのアプローチで進める限りがん治療としての成果に結びつかなかった。

・免疫のブレーキPD-1分子を発見し、
⇒約20年の歳月を掛けてPD-1阻害により(治療薬(認可))がん治療が出来る事を証明。
その特徴は大きく分けて3つ。

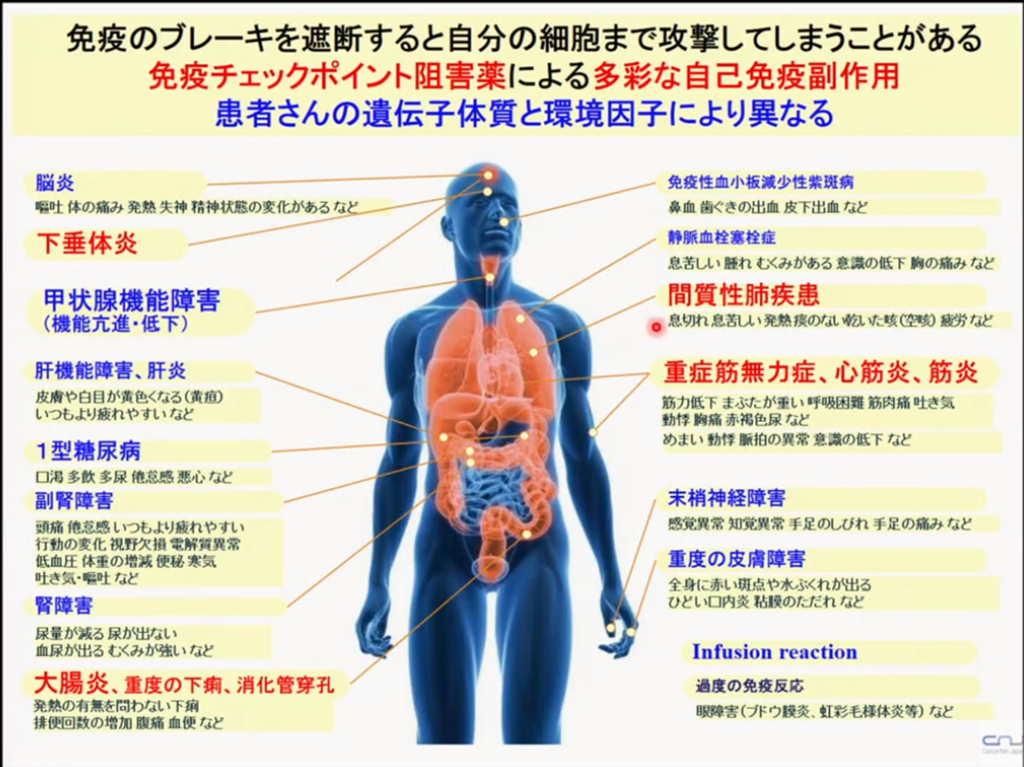
1.正常細胞が影響を受けないので副作用が少ない。
⇒PD-1抗体は正常細胞を殺す訳ではない。
但し、活性化し過ぎた為による免疫による自己免疫病ということが起こり得る。

出典:https://www.youtube.com/watch?v=XKYFzEwTg6o
2.広範囲ながん種に効果がある。
(現在2000以上の治療進行中:PD-1と他の組合せ。例:最大のパートナーはCTLA4)。
⇒PD-1治療はたった一つの薬で何十種類のがんに対して既に認可がされている。
⇒抗がん剤はがん種毎に薬剤を変えて主になるがんを治療。
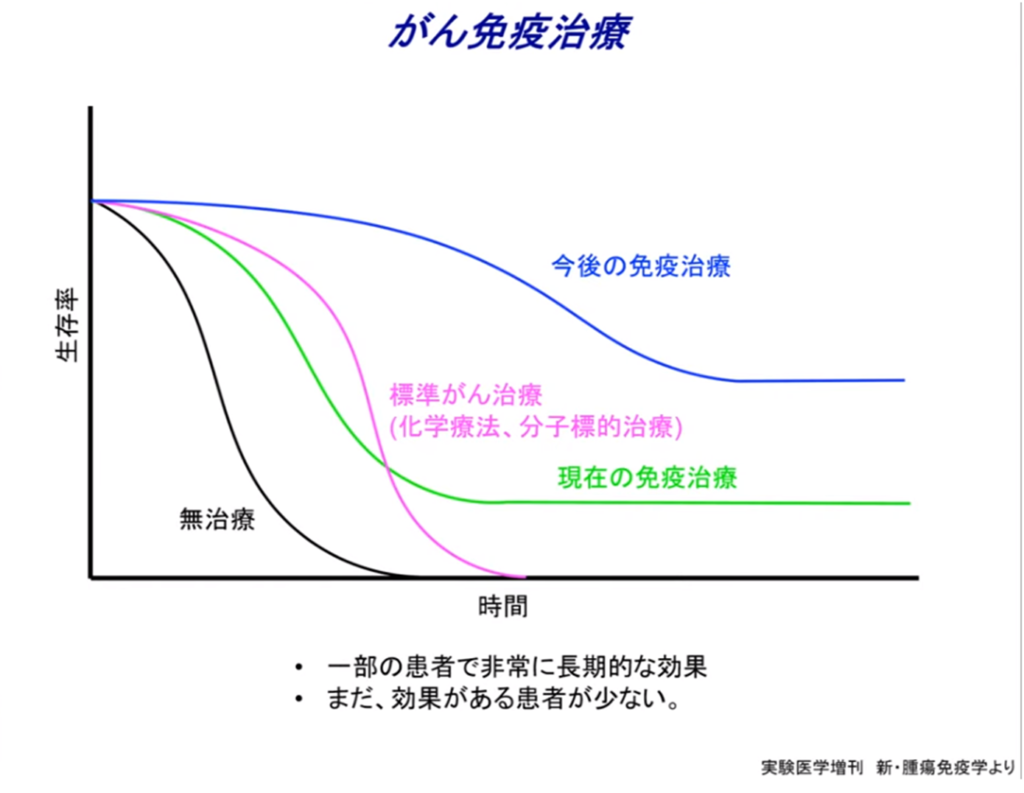
3.治療を止めても効果が長く続く。
・誰もが想定しなかったことが起きた。
⇒治療に患者が反応しだし、腫瘍が小さくなってかなり進んだところで治療を止めても、どんどんと更にガンが無くなっていく。
⇒あるいは急に再び大きくなるということが起こらない。
*何故こういうことが起きるのかはよく分からない。従来のがん治療と違う。
出典:がん免疫治療の新展開 – 本庶 佑 – 第8回 京都大学 − 稲盛財団合同京都賞シンポジウム(2022年2月13日)
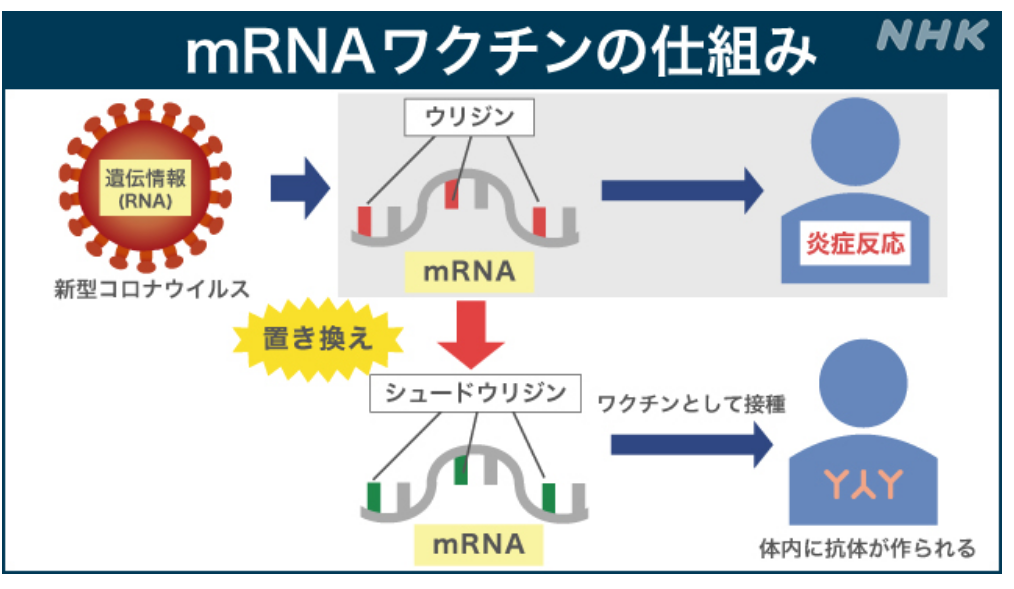
■mRNAワクチンの積み荷の修飾と保護
⇒mRNAワクチンを成功させるにはmRNAを体内に運搬できる技術が不可欠である。
⇒もし、mRNA配列が何の防御策もなく体内に注入されると、
⇒免疫系に異物として認識され破壊されてしまう。
・通常の合成mRNA
⇒マウスに注射すると、
⇒重い炎症反応が起きる。
⇒病原体からの危険信号に最初に応答するToll様受容体と呼ばれる一連の免疫センサーを、
⇒合成mRNAが刺激(攻撃)するからである。
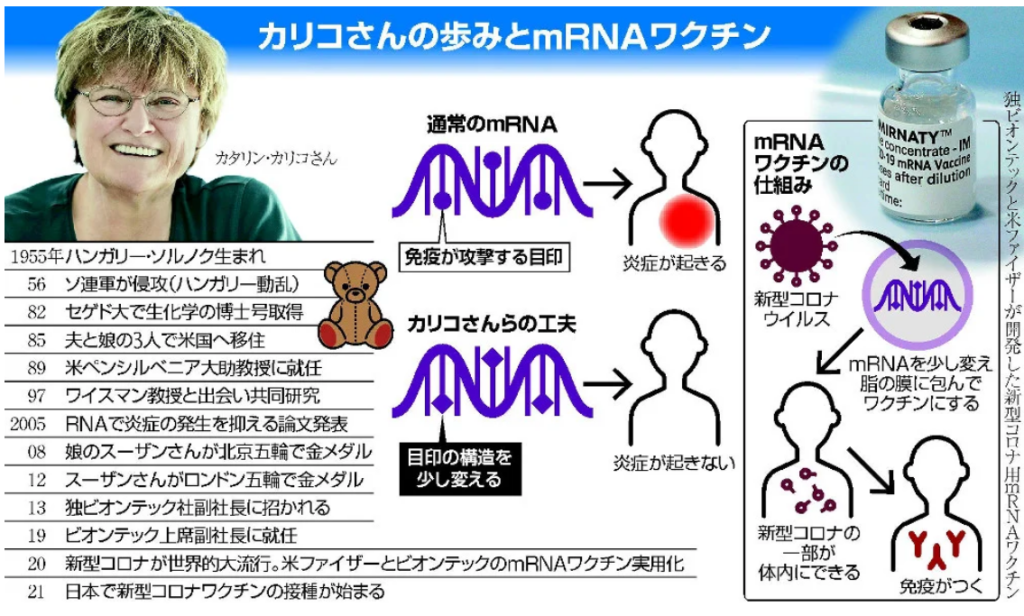
・『mRNAワクチンの成功のカギとなる発見』
⇒カタリン・カリコ博士とワイスマン教授が発見。
⇒mRNAのコードの一部を改変(シュードウリジン修飾)すると、
⇒合成mRNAが
⇒細胞の自然免疫の防御機構を擦り抜けられる(攻撃回避)ようになる、という発見だった。
⇒2人は2005年、『RNAで炎症の発生を抑える論文』を発表した。
・科学界での当初の反応とその後の展開
⇒当時、こうした修飾ヌクレオチド(シュードウリジン修飾)が
⇒治療に役立つと認識していた科学者はほとんどいなかったが、
⇒科学界はやがてその可能性に気付き始めた。
・修飾mRNAを使った治療の試み
⇒2010年9月、ボストン小児病院の幹細胞生物学者Derrick Rossiの研究チームが、
⇒修飾mRNAを使って繊維芽細胞を胚性幹細胞に形質転換し、
⇒さらにそれを、収縮可能な筋肉組織に分化させられたと発表した。
⇒この発見は大きな話題となった。
◆カリコー・カタリン博士のmRNAワクチン開発研究:動画紹介
・ハンガリー大使館/ハンガリー科学アカデミー Hungarian Embassy/Hungarian Academy of Science
⇒動画では博士本人が、
⇒生涯にわたるmRNA研究と今回のワクチン開発に至るまでのキャリアについて語ります。
■一部の開発中のがんワクチンが採用している解決策(免疫攻撃の回避策)
①mRNAを脂質ナノ粒子(mRNA分子を保護する微小球体)で包装する事により、細胞内に送り込む役割を担っている。
⇒ファイザー社/ビオンテック社のmRNA新型コロナワクチンでは、
⇒脂質ナノ粒子に封入されたmRNAが使用されている。
注)脂質ナノ粒子(LNP)と呼ばれる脂肪でできた小さな泡
⇒このナノ粒子には4種類の脂質分子が混合されている
⇒そのうちの3つは構造と安定性に寄与し
⇒イオン化脂質と呼ばれる第4の脂質分子が、LNP成功のカギ。
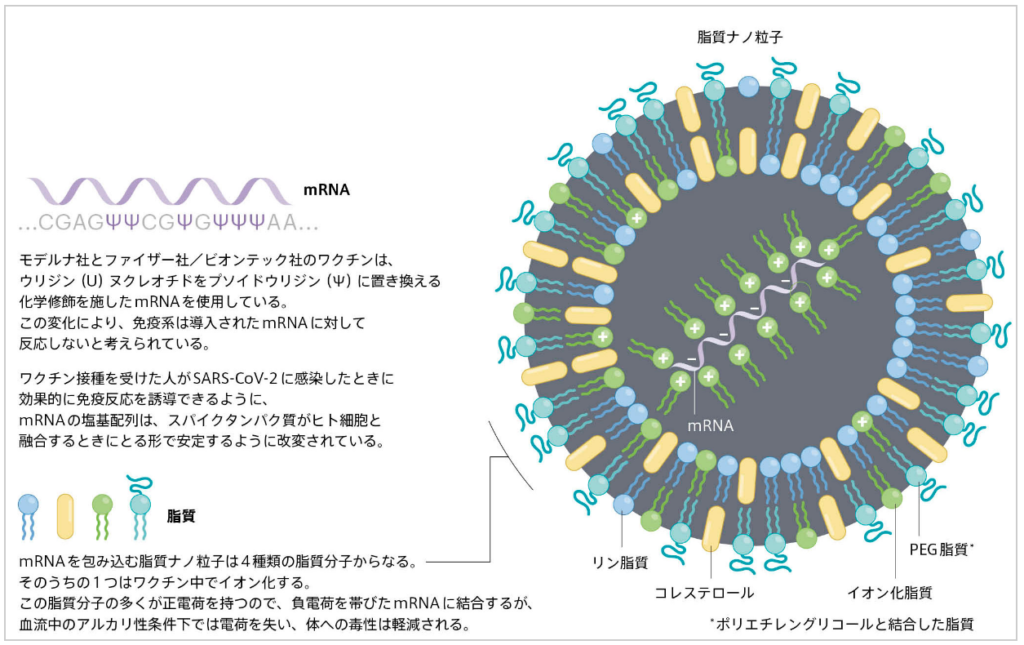
mRNAベースのCOVIDワクチンは、脂肪の泡である脂質ナノ粒子を利用して細胞内にメッセンジャーRNA(mRNA)分子を送り込む。
このmRNAには新型コロナウイルス(SARS-CoV-2)が細胞内に侵入する際使用するスパイクタンパク質の設計図がコードされていて、接種を受けた人の細胞にスパイクタンパク質を作らせる。このワクチンの設計の革新的な点を上図に示す。 出典:Nature Japan Nature ダイジェスト Vol. 18 No. 11 Feature
mRNAワクチン完成までの長く曲がりくねった道
②もう1つの重要な特徴は、修飾型mRNAを使用している(カリコ博士とワイスマン教授が発見)
⇒こうしたワクチンのmRNAには、シュードウリジン(天然に存在するヌクレオシドの修飾体:炎症反応を抑える物質)が組み込まれている。
⇒ヌクレオシドはmRNAの構成要素で、
⇒特定のヌクレオシドの配列によってmRNAが細胞内のタンパク質合成機構に与える指令内容が決定される。
⇒シュードウリジン修飾により、免疫系がmRNA自体をほとんど認識できなくなるようだ。
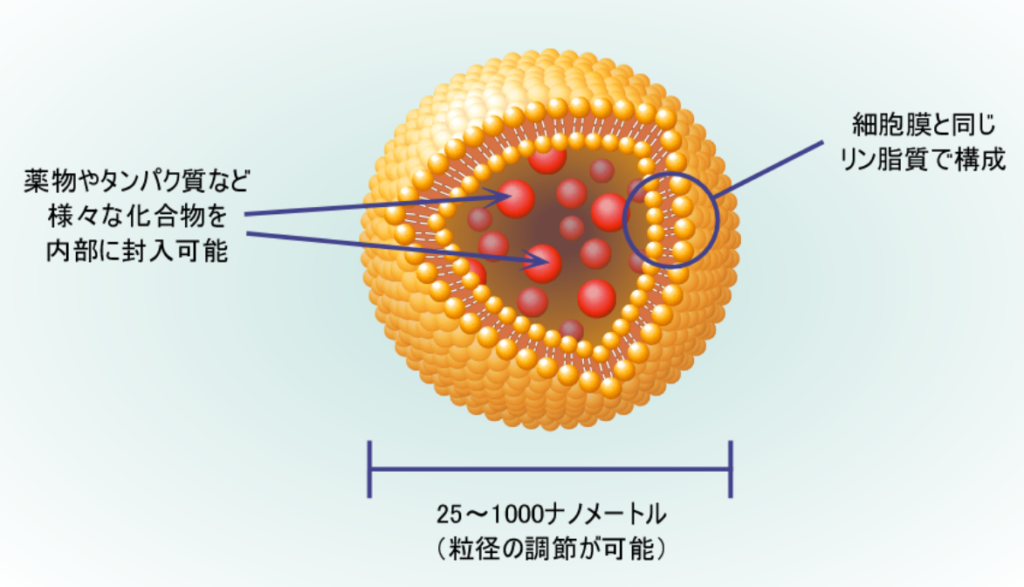
③その他の送達手段には、リポソーム(小胞、つまり泡状の物体の一種)がある。
⇒リン脂質からなる数10~数100nmの粒径をもつ微小なカプセルであり、
⇒その内部に様々な分子を封入することができると共に、
⇒生体適合性や生分解性にも優れていることから、
⇒その発見以来、薬物や生理活性物質の理想的な運搬体と考えられてきた。
⇒その他の用途として化粧品もある。
◆mRNAワクチンの歴史
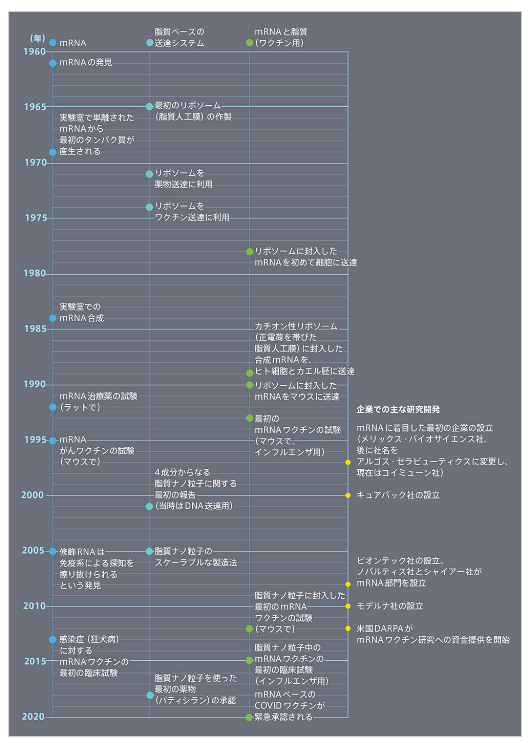
mRNAワクチン完成までの長く曲がりくねった道
以上は『Nature JapanNature ダイジェストVol. 18 No. 11FeaturemRNAワクチン完成までの長く曲がりくねった道』より一部抜粋して転記
■新型コロナウイルスmRNAワクチン開発の見取り図
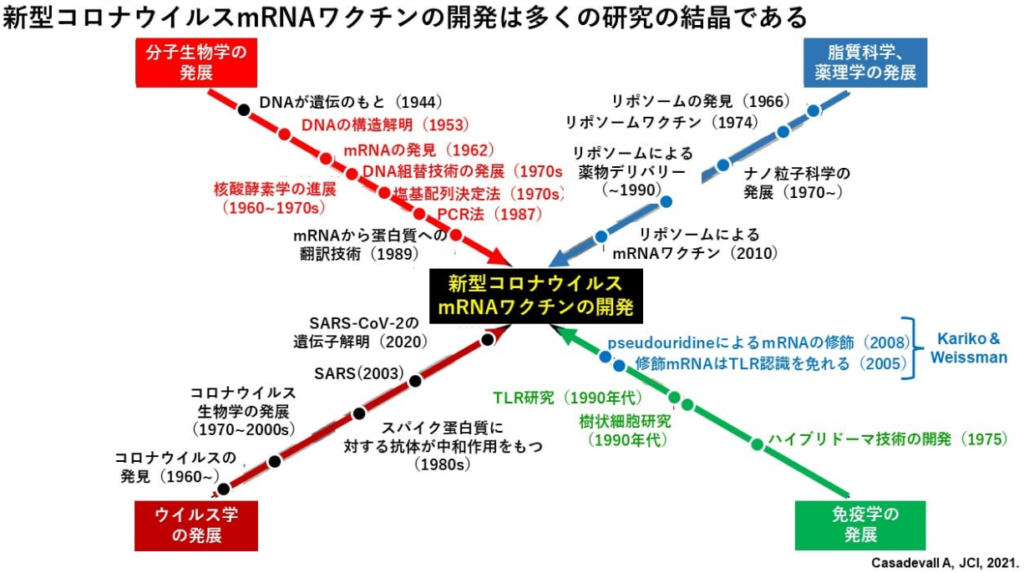
出典:JCI The journal of Clinical Investigation
■現在のmRNA癌ワクチンの位置
◆がん免疫治療の現在地
・免疫チェックポイント阻害薬(抗PD-1抗体等)の治療傾向
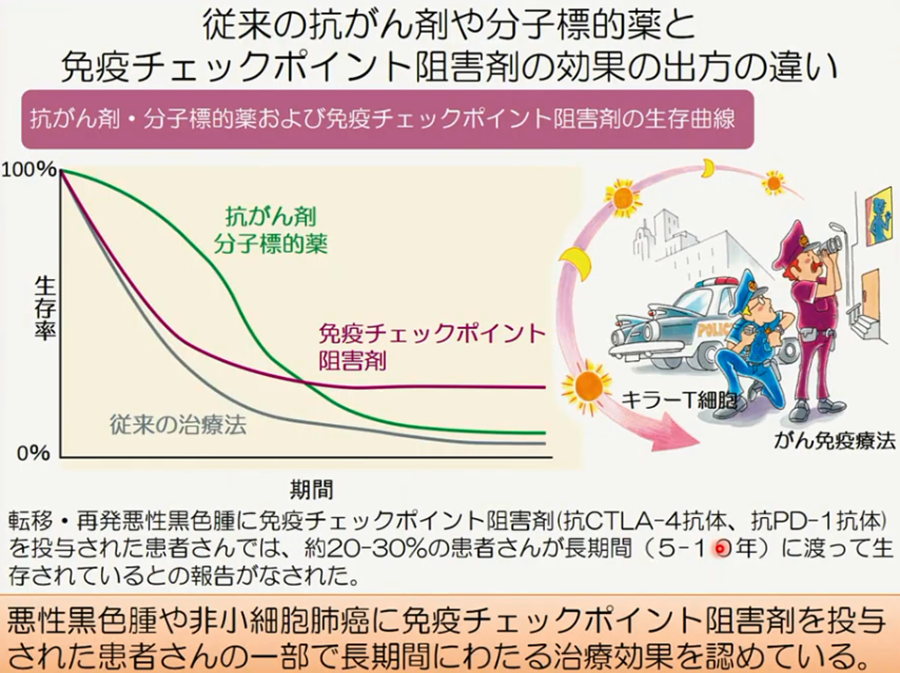
・免疫チェックポイント阻害薬(抗PD-1抗体等)による多彩な自己免疫副作用
・mRNA癌ワクチンの登場で期待される今後の免疫治療カーブ
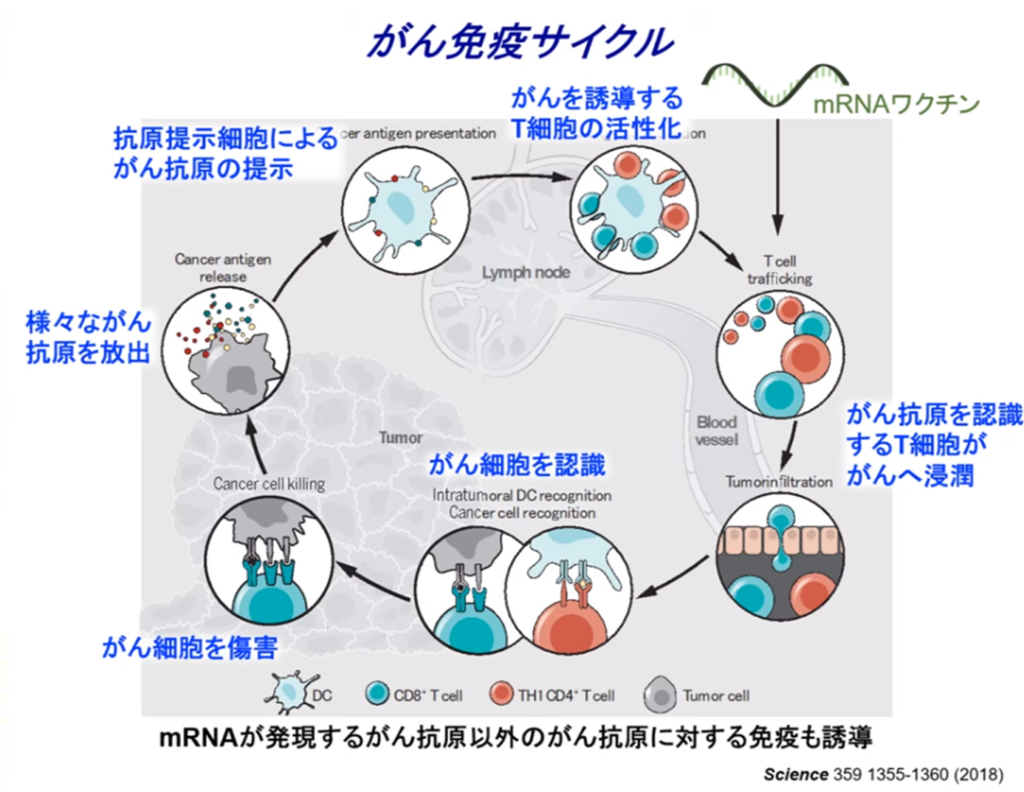
◆アクセル(mRNA癌ワクチン)を踏む治療とブレーキ(免疫チェックポイント阻害薬)を外す治療にもなる『キラーT細胞』を使って『がん治療』が出来ないか?
・キラーT細胞がいなとガン細胞に攻撃が出来ない
⇒ガン細胞は生きたままで増殖・転移していく。
・二つの治療を組み合わせる事で
⇒がん治療に効果を上げられないかと試行がされている。
◆mRNAを医療に活用する試みは『最初に』癌ワクチンで始められた
・世界では2000年初頭に開始された
・一方、感染症ワクチンは
⇒新型コロナウイルスが世界規模でのパンデミック化により一気に加速した。
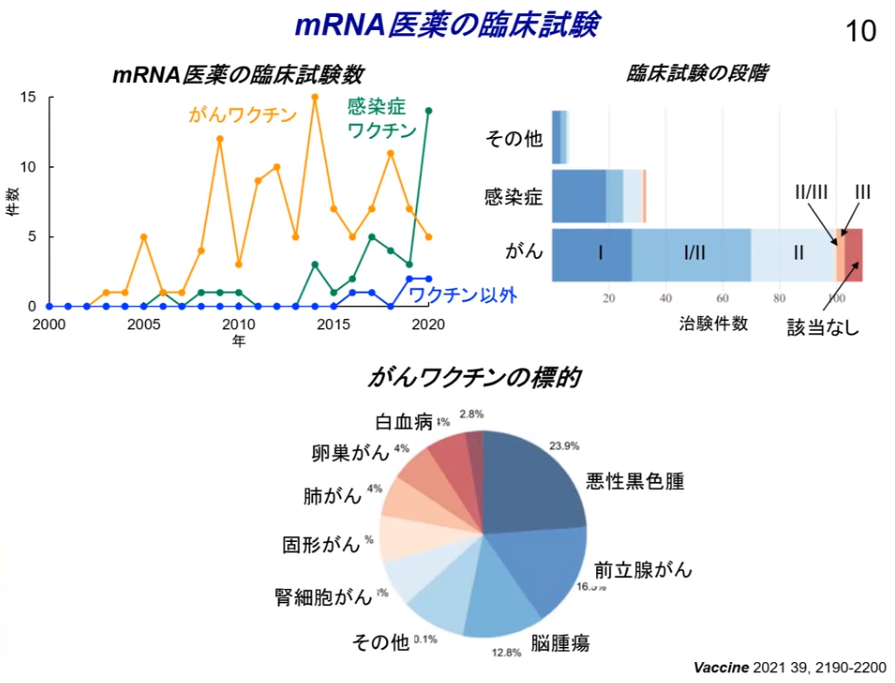
■大きく分けて二つの戦略が採用された
◆戦略1.腫瘍関連抗原
・それぞれのがん種で(皮膚がん、前立腺がん等)
⇒高頻度に発現しているタンパク質(抗原)を
⇒あらかじめmRNAとして作成しておき、これを投与することで
⇒癌ワクチンとして治療する。(左上図)
・皮膚がんを対象とした臨床試験(独ビオンテック社で成功した『二人のケース』)
⇒4つの腫瘍関連抗原のうち、最低1つを発現している症例(患者)に
⇒4つの腫瘍関連抗原のmRNAを同時に投与し(右上図)
⇒かつ既に免疫チェツク阻害剤を投与されている患者(二人)
・mRNA癌ワクチンと免疫チェックポイント阻害薬の『がん治療組合せ』の事例(左下図)
⇒免疫チェックポイント阻害薬だけでは『がん細胞=肺転移巣』が大きくなっていた。
⇒mRNA癌ワクチンを投与後(84日後)に『がん細胞=肺転移巣』は小さくなった。

・多種の持続的な腫瘍増殖抑制効果事例(多数の臨床事例:右下図)
⇒効果が無く腫瘍サイズが大きくなった事例も半数以上が占めるが、
⇒『効く方にとって』は長期(二年程度)に渡り持続する事例も少数あり、
⇒画期的な治療である。
・二つの問題点
①投与しているmRNAには正常のタンパク質のmRNAであるので
・がん細胞だけでなく、
⇒正常な細胞も攻撃している可能性がゼロではない。
②免疫寛容を乗り越える
・免疫細胞が有害物質(癌、ウイルス等)を排除しつつ
⇒正常組織を攻撃しないように、つまり免疫が働かないようにして
⇒癌ワクチン効果を出す。
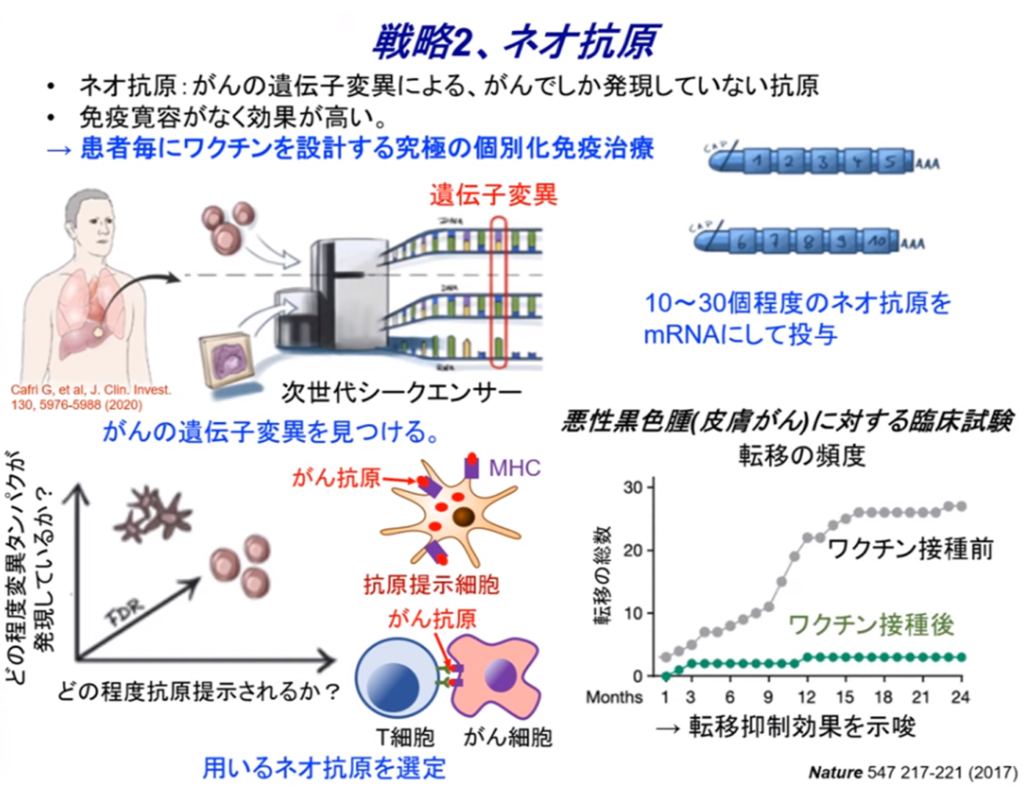
◆戦略2.ネオ抗原
・戦略1.腫瘍関連抗原の『二つの問題点』を克服する
⇒ネオ抗原に着目
・がん細胞は
⇒正常細胞の遺伝子変異によって生じ、
⇒正常細胞には無い、
⇒がんでしか作られないタンパク質を標的にした
⇒癌ワクチンが可能になる。
⇒これにより免疫寛容が無く、効果が高くなる。
・患者毎の遺伝子を調べる
⇒患者に合ったmRNAを設計しする究極の個別化医療(左上図)
・既に臨床段階まで来ている。
⇒遺伝子変異を調べる事が(次世代シークエンサー)直に出来るようになった。
◆がんの遺伝子変異を見つける(左下図)
(この段階から難易度が上がる)
①遺伝子変異によって作られるタンパク質が
⇒どれ位、癌が作っているか?を確かめる事
②がんの表面に遺伝子変異したタンパク質(抗原)を提示して
⇒キラーT細胞に認識され易くしているか?を予測する必要がある。
上記2点を実験したり、AI予測を用いて複雑・難解な過程を試行錯誤しながら
・ネオ抗原という(右上図)
⇒標的と目印になるmRNAのタンパク質を見つける
⇒変異した中から10個~30個程度のネオ抗原を見つけ、
⇒それをmRNAにして癌患者に投与する。
・悪性黒色腫の事例(ビオンテック)(右下図)
⇒癌ワクチン接種前と接種後の癌転移比較
⇒臨床中で完全なデータではないが
⇒転移抑制効果を示唆。
出典:講演2「メッセンジャーRNAワクチン~新型コロナウイルスからがん治療へ」
■mRNA癌ワクチンの情報
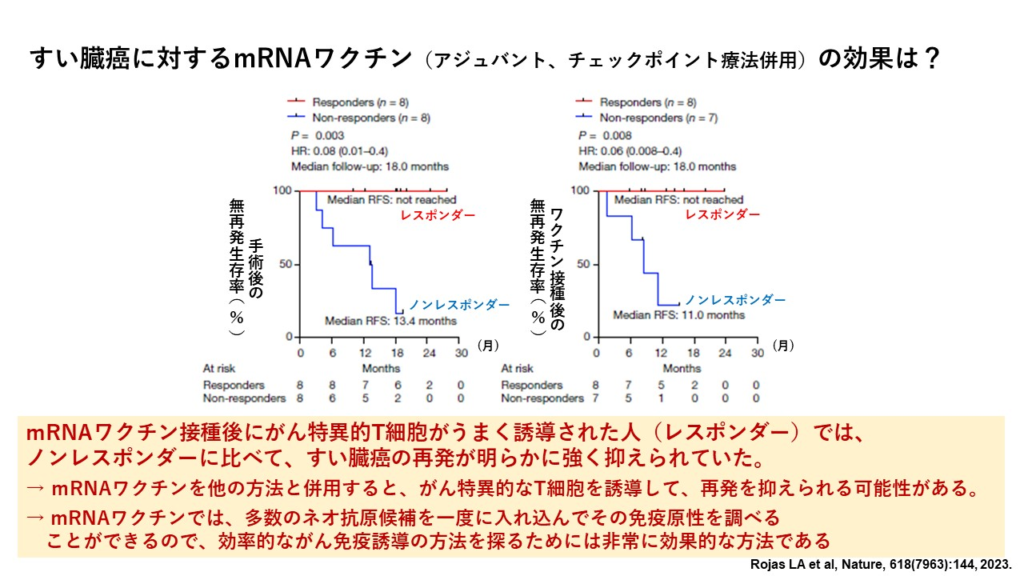
出典:宮坂 昌之 大坂大学 名誉教授 facebook (2023年10月14日付投稿記事より)
・同氏の投稿記事内容
すい臓癌は、手術をしてもほとんどの患者で7~9か月後で再発が認められ、5年生存率は10%以下で、化学療法をしても5年生存率が30%に届かないという、もっとも治療抵抗性の高い悪性腫瘍の一つです。最近、ノーベル賞で有名になったチェックポイント療法(免疫細胞のブレーキを解除する治療法)はほとんど効果がありません。
それにはいくつかの理由があります。一つにはこの癌ではがん細胞だけが発現するネオ抗原に対する免疫反応がそもそも弱いことがあります。がん細胞の免疫原性(免疫反応を起こす力)が低いのです。もう一つは、この癌では既知のチェックポイント経路以外の免疫抑制経路が存在する可能性です。しかし、もし強い免疫反応を起こすネオ抗原が見つかり、さらに新たなチェックポイント経路が同定できれば、すい臓癌に対するがん免疫療法は必ず有効となるはずです。
このことを前提に、アメリカの研究グループがすい臓がんに対してmRNAワクチンとアジュバント(=非特異的免疫促進剤)とPD-L1経路をブロックするチェックポイント療法を3つ併用するという試みを行っています。mRNAワクチンの場合、複数の抗原を使えるので、ネオ抗原候補のmRNAを20個近く一つのワクチンに入れ込んでいます(そのどれかがうまく働けばいいので)。
まだ第一相試験の段階ですが、なかなか有望な結果が報告されています。細かいデータは省きますが、mRNAワクチンを投与した16例中8例でT細胞が強く反応し、用いたネオ抗原に対する特異的なキラーT細胞が検出されました。つまり、mRNAワクチンで使われたネオ抗原の中に強い免疫反応を起こせるものがあったということです。そしてT細胞が良く反応した人たち(=レスポンダー)では反応しなかった人たち(=ノンレスポンダー)に比べて、ワクチン接種後の無再発生存期間がはるかに長いことがわかりました。つまりレスポンダーではノンレスポンダーに比べて明らかに再発が長期間抑えられているという結果が得られました。つまり、mRNAワクチンを他の方法と併用すると、がん特異的なT細胞が誘導できて、再発を抑えられる可能性があるということです。
これはまだワクチンの安全性を調べるという第一相試験の結果ですが、すい臓癌でここまでの効果が見られているというのは驚きです。今後もっと多くの被験者で、より長期間、ワクチンの効果と安全性が確認される必要がありますが、このような試みは多数のネオ抗原を一度に調べることができるmRNAワクチンだから出来ることです。
・2023年10月18日 同氏のfacebook投稿より
つい最近、mRNAワクチンがすい臓癌治療で実験的に用いられていて、接種を受けた人たちの中で高いT細胞反応性が出現した人ではかなり長期的にがんの再発抑制が見られていることをFB上で紹介しました(https://www.facebook.com/masayuki.miyasaka.9/posts/pfbid02Pc5yFED2qdKU7ERK5Jj9TDLNDLfk7pNijYbhUEvcUndBQmcCcTpbW4k5eZgwFtbZl)。
アメリカではこのほかに、現在、メラノーマ(悪性黒色腫)の治療でもmRNAワクチンがチェックポイント阻害剤とともに使われ始めていて、その結果が非常に良いことが、きょう入ってきたNatureのNewsで紹介されています。
それによると、これまでに約1,000名が臨床治験に参加し、モデルナ社が作ったメラノーマ用mRNAワクチンとチェックポイント阻害剤(抗PD-1抗体ペンブロリズマブ)を併用した群では、チェックポイント阻害剤単独使用群に比べて、手術後の死亡が44%も抑えられていた、とのことです。大きな効果だと思います。なお、本治験におけるmRNAワクチンの副反応は主に注射部位の痛み、疲労感と寒気ですが、重篤なものは今のところありませんでした。
このモデルナが作ったメラノーマ用mRNAワクチンは、患者の腫瘍からネオ抗原と思われる配列を選び、それを9~34種類、mRNAの形で脂質ナノ粒子に封入し、それを3週間に1回、計9回筋注し、さらに抗PD-1抗体も9回投与するという方法をとっています。現在では、患者ごとにワクチンを作るために約6週間かかっていますが、これをなんとか4週間ぐらいまでに短縮できるよう努力しているとのことです。
mRNAワクチンの利点はネオ抗原を患者ごとに多数選んでそれを一度にワクチン内に封入できることです。このために治療の当たる確率が大きく上がってきます。
このようにmRNAワクチンはがんの免疫療法の分野においても非常にめざましい治療効果をもたらしています。