世界の人口は2019年の77億人から2030年の85億人(10%増)へ、さらに2050年には97億人(同26%)、2100年には109億人(42%)へと増えることが予測されている。
30年後には100億人を地球上の土壌より食料生産して養わなければならない。
この土壌を地球スケールで眺めてみると地殻表面の数cmからせいぜい数mの厚さしかなく、全地球平気で18cmの厚みしかない。
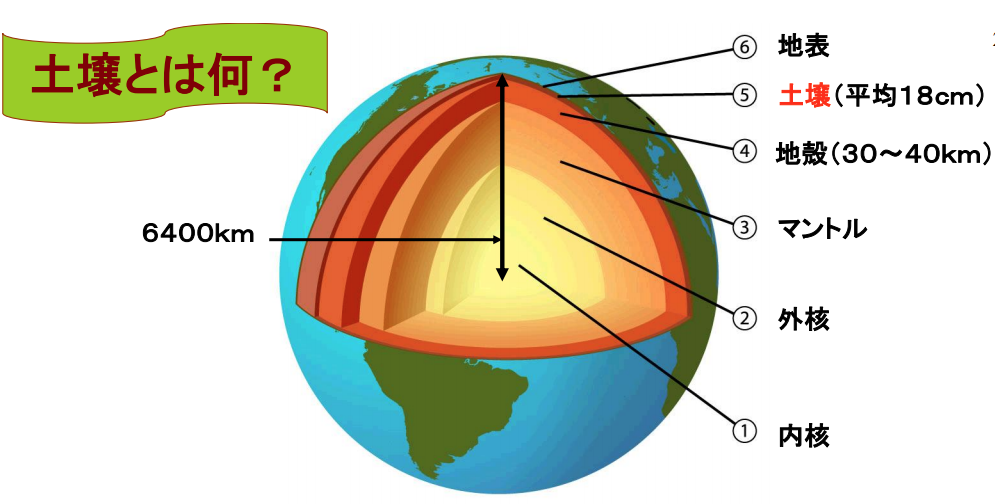
地球の内部構造は,しばしば卵にたとえられ、卵殻にあたる最も外側の部分(厚さ40 km)は地殻と呼ばれ,主に花崗岩や玄武岩と呼ばれる岩石からできている。
卵白に相当するマントル(地殻の下約2,900 kmまで)は,カンラン岩またはそれと似た化学組成の岩石からなっていると考えられている。
卵黄にあたる中心部は,金属鉄からできており,液体状態の外側の部分 (深さ2,900~5,100 km)は外核,それ以深の固体部分は内核と呼ばれている。
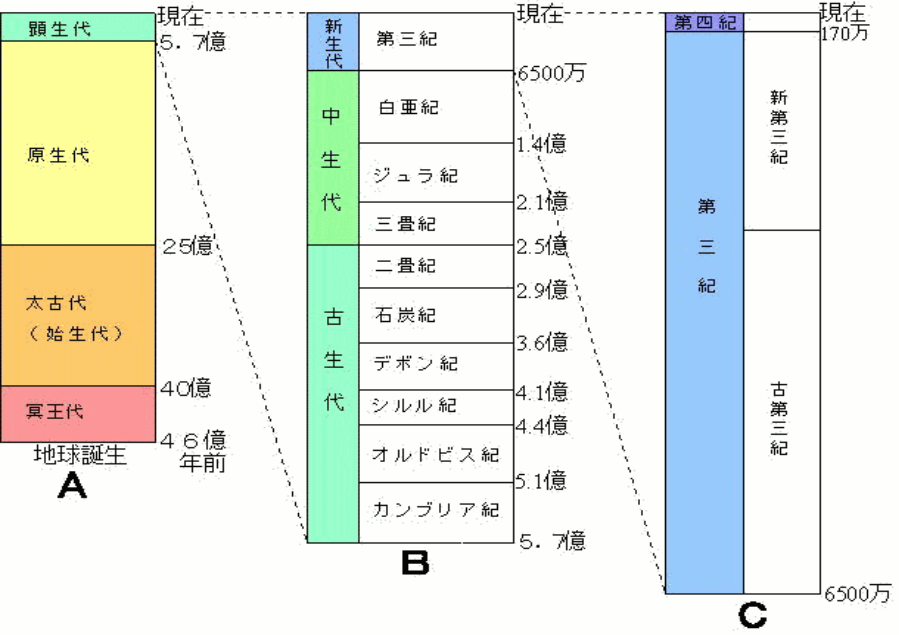
時間スケールで眺めてみると地球が誕生して約46億年が経過している。
地球で最も古い岩石は約40億年前のものが知られている。そのような岩石には岩石ができた時の条件(温度,圧力など)や過程(例えば,マグマが冷えて固まったとか海底で堆積したとか)も記録されている。

注:上図は縞状鉄鉱層(オーストラリア,ハマスレー鉱山近くで採集)。25~18億年前に海底で堆積。
■岩石の種類
岩石は三種類からほぼ成り立つ

①火成岩 – マグマが地下で冷えて固まってできたもの

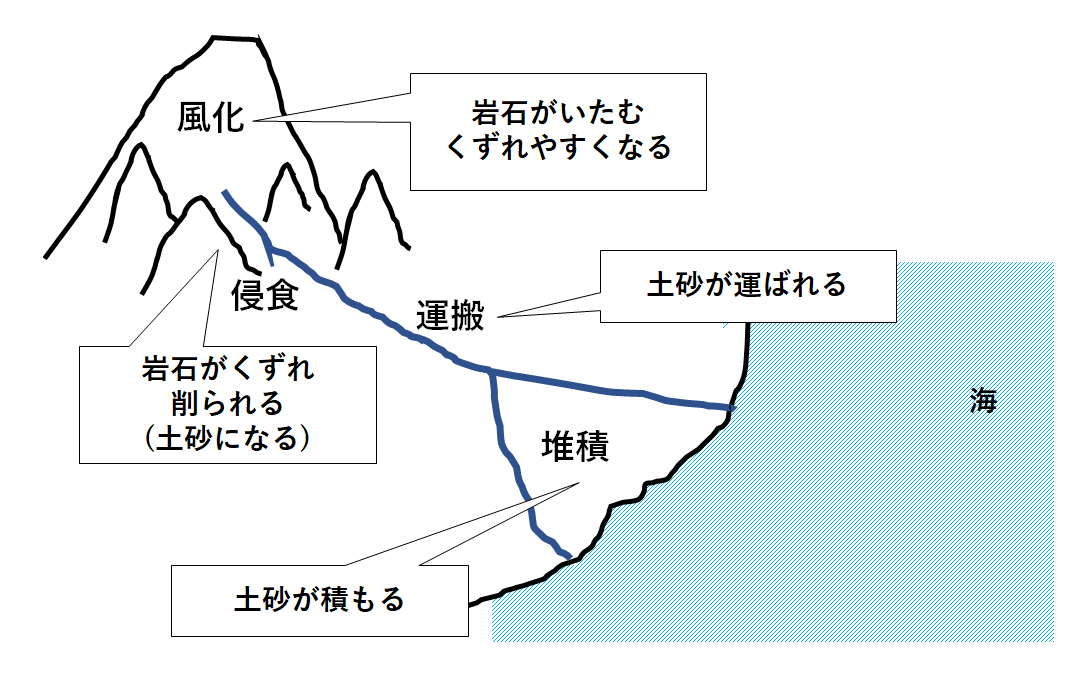
②堆積岩 – 土砂などが地表にたまってできたもの
⇒堆積岩は少なくとも次の5つに大別される。
風化→浸食→運搬→堆積→固結
③変成岩‐火成岩や堆積岩が地下で変化してできたもの
⇒火成岩や堆積岩が地下深く押し込められたり、マグマと接したりして高温高圧条件におかれると、新しい鉱物ができて違う岩石に変わる。
こうした変化を「変成作用」といい、鉱物が変化したり、新しい鉱物ができたりすることを「再結晶作用」という。

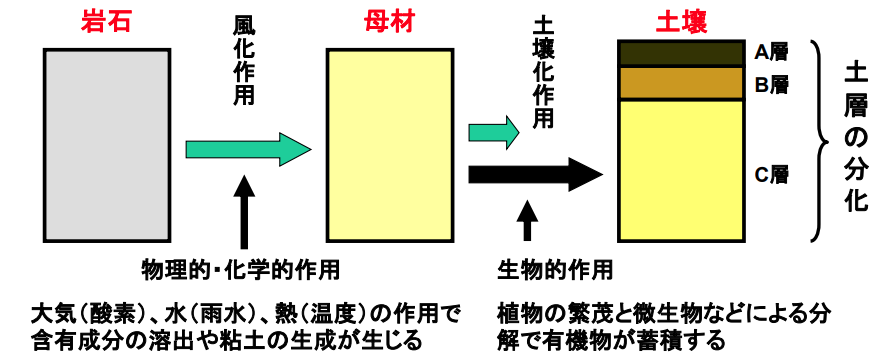
■土壌の生成
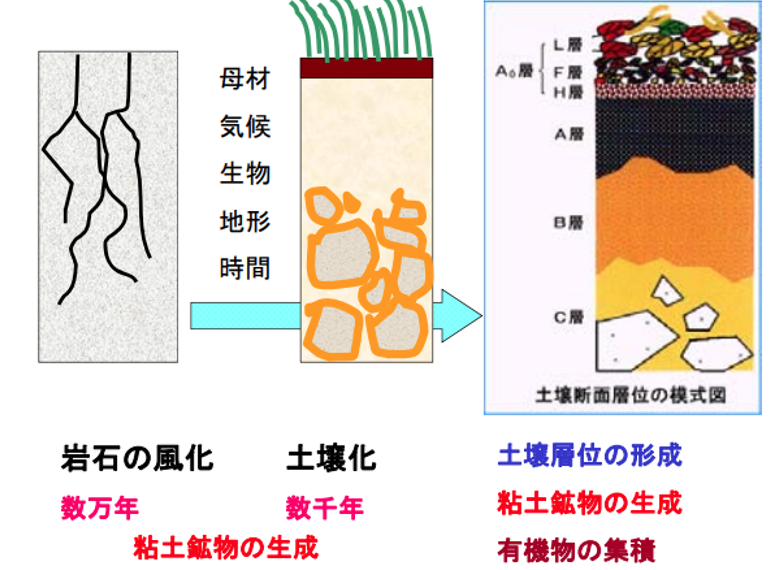
地殻表面の数cmからせいぜい数mの厚さしかなく、全地球平気で18cmの厚みしかない土壌の生成過程を確認しよう。
土は主に岩石が気象などによって形や性質を変える風化作用を受けて生成され、一部には植物の腐食によって生じた土もある。
◆風化作用
・物理的風化
⇒温度の変化によって岩石にひずみが生じたり、岩石の亀裂内の水が凍結・融解を繰り返す事により破砕して、岩石が細分化していく。
⇒流水や風などの作用によって岩石が侵食され細分化する事もある。
・化学的風化
⇒岩石中の鉱物と水が接触して化学反応を生じる加水分解
⇒炭酸ガスを含む水による鉱物の溶解
⇒岩石中の鉄分の酸化作用
化学的風化は雨水や地下水による溶解と粘土鉱物の生成という形を取る。
空中を雨が落下する時に空中の二酸化炭素(CO₂)を取り込み炭酸水素イオン(HCO₃⁻)が形成され、この雨水が地表で岩石と反応してカルシウム(Ca)やマグネシウム(Mg)を溶かし出し、成分として残ったアルミニウム(Al)やカリウム(K)に富む粘土鉱物を生成する。
粘土鉱物には、大別して、カオリナイト、モンモリロナイト、イライトと呼ばれるものがある。
これらの作用では、もともとの鉱物から溶脱しやすい成分は次の順番になる。
塩素(Cl)>硫酸塩(SO₄)>ナトリウム(Na)>マグネシウム(Mg)>カルシウム(Ca)>カリウム(K)>アルミニウム(Al)
・生物的風化
⇒岩石の割れ目で植物の根が成長する事によって岩石を破砕する作用もあるが、根の腐食の際に生成される炭酸や有機酸が岩石鉱物を溶解していく。
以上の3つに風化作用は大別される。
■土壌鉱物
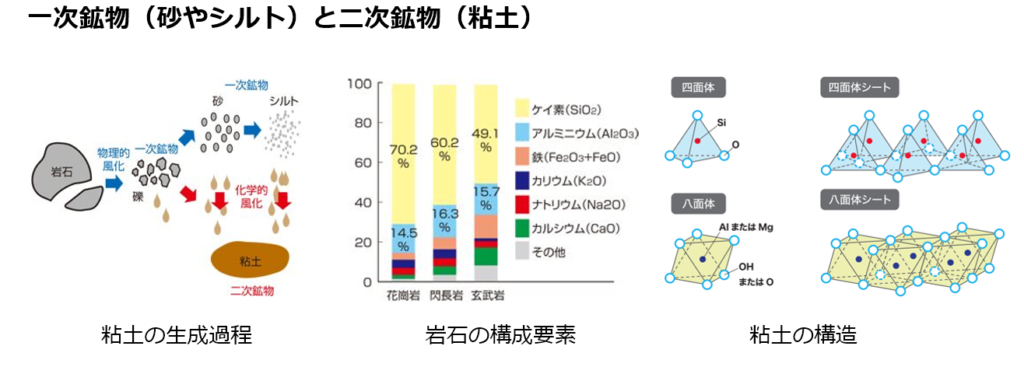
生成の過程の違いで、
砂やシルトなどの「一次鉱物」と粘土の「二次鉱物」に分けられる。
母材となる岩石が崩壊し微小な粒子と変化するが、粒子の大きさにより粗砂、細砂、シルト、粘土に分けられている。


一次鉱物は、物理的風化を受けたもので、組成は岩石と変わらない。
二次鉱物である粘土は、化学的風化を受けたもので、砂やシルト中の成分が溶けて、ケイ酸(Si)とアルミニウム(Al)が再結合・結晶化し(加水分解・酸化)、反応性に富む。
その構造は、ケイ酸四面体シート(Si⁴⁺)とアルミニウム八面体シート(Al³⁺)が骨格となり、層状に重なる。
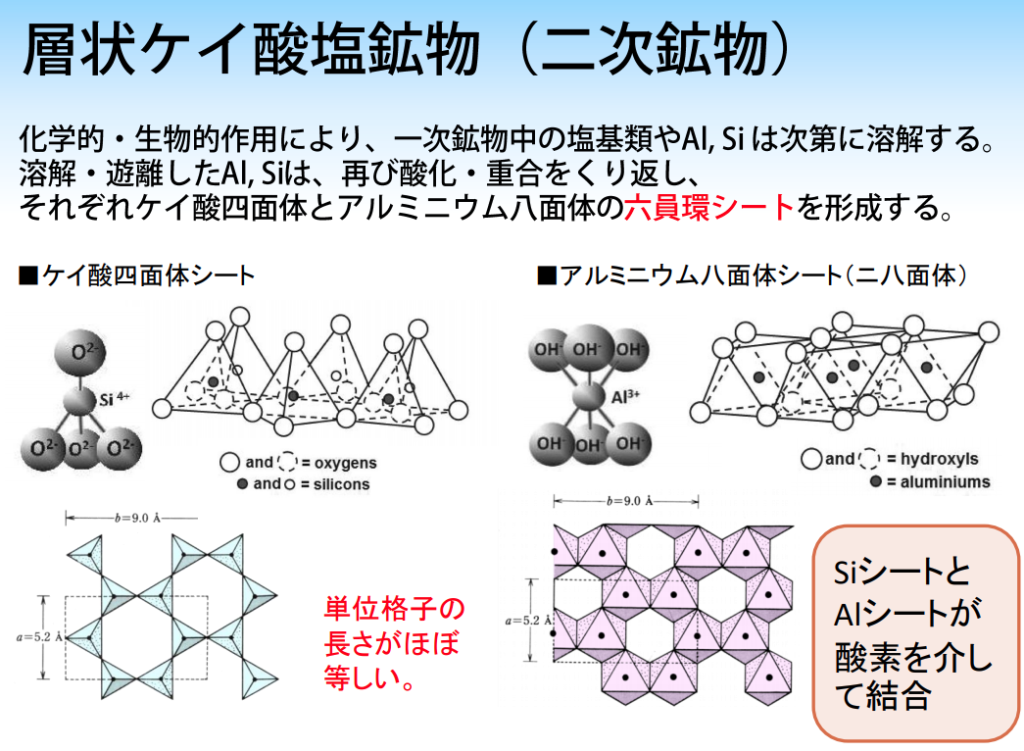
◆粘土鉱物の種類
粘土はケイ酸シート(Si⁴⁺)とアルミニウムシート(Al³⁺)の組合せの違いで次の3種類に分けられる。
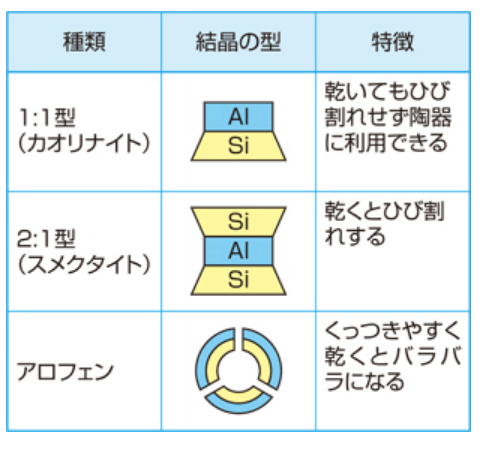
①1:1型粘土(カオリナイト・ハロイサイト)
・ケイ酸シート(Si⁴⁺)とアルミニウムシート(Al³⁺)が1:1の割合で構成されている粘土を1:1型といい、カオリナイト系とも呼ばれる。
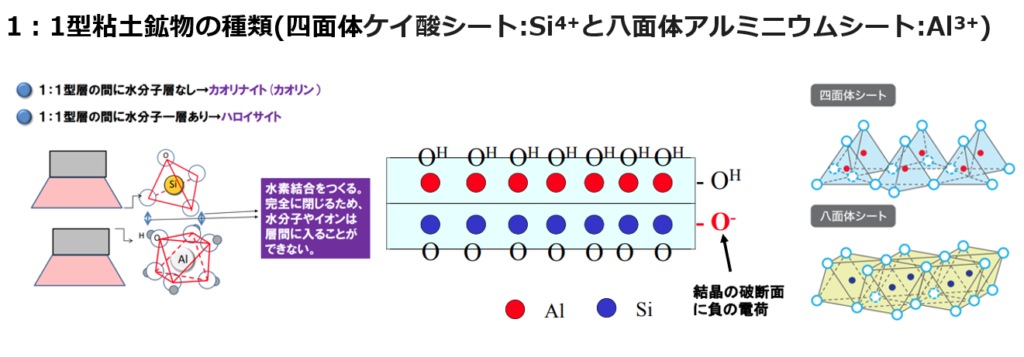
⇒乾いてもひび割れせず陶器材料に利用される有用な鉱物であるが、
⇒農業分野での評価は高くなく、
⇒カオリンが粘土鉱物の主体になっている土壌は、保肥力が低く生産力が弱いという特徴がある。
このような土は、有機物をある程度施してカオリナイトの弱点を補う事が求められる。
日本の土に含まれる粘土鉱物は、
火山灰土以外はほとんどこのカオリナイト族である。
年間降水量が2,000mm程度の日本では
岩石の風化の過程で、ケイ酸(Si)分がどんどん流れるが、アルミニウム(Al)はあまり流出しない。
②2:1型粘土(モンモリロナイト・スメクタイト)
・アルミニウムシート(Al³⁺)をケイ酸シート(Si⁴⁺)2つでサンドイッチ状になったものを2:1型といい、モンモリロナイト系とも呼ばれる。
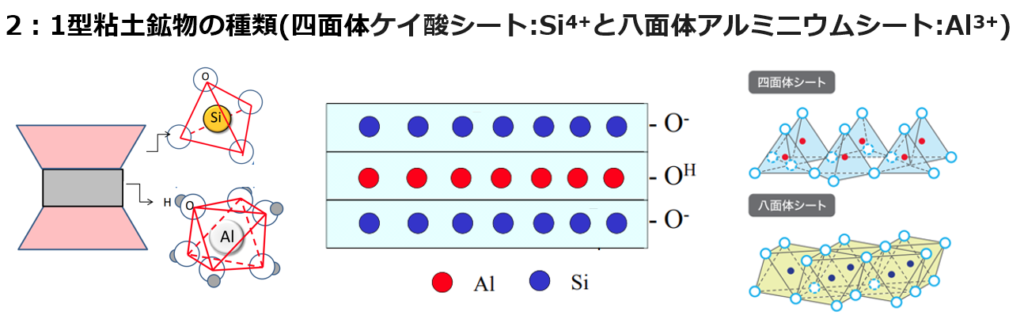
⇒カオリナイトに比べて、高い農業生産力がある。
⇒ウクライナの『チェルノーゼム』、アメリカ中央部の『プレーリー』、アルゼンチンの『パンパ』といった世界の穀倉地帯は、モンモリロナイトが粘土鉱物の主体となっている土壌。
日本でが一部モンモリロナイトは見られるが、稀である。
③アロフェン・イモゴライト
・アロフェンやイモゴライトは、主として火山灰土壌地帯に含まれる粘土。
その構造は1:1型や2:1型のようなシート状ではなく、アルミニウム(Al)が外側、ケイ酸(Si)が内側になった中空の球形や円筒状をしている。
⇒くっつきやすく、乾くとバラバラになる性質がある。
⇒肥料成分を吸着する量は多いが、吸着する力は弱いという特徴がある。
◆粘土鉱物だけが持つ養分吸着機能(電子のやり取り)
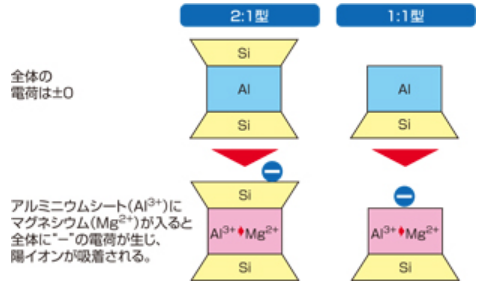
粘土鉱物はアルミニウムシート(Al³⁺)とケイ酸シート(Si⁴⁺)で出来ており、電荷はプラス・マイナス0で均衡を保っている。
しかし、粘土の結晶が生成される途中でアルミニウムシート(Al³⁺)の一部がマグネシウム(Mg²⁺)に置き換わる、
あるいはケイ酸シート(Si⁴⁺)の一部がアルミニウムシート(Al³⁺)に置き換わると、
陽イオン(⁺)が不足する事により、粘土全体の電荷が陰イオン(⁻)になる。
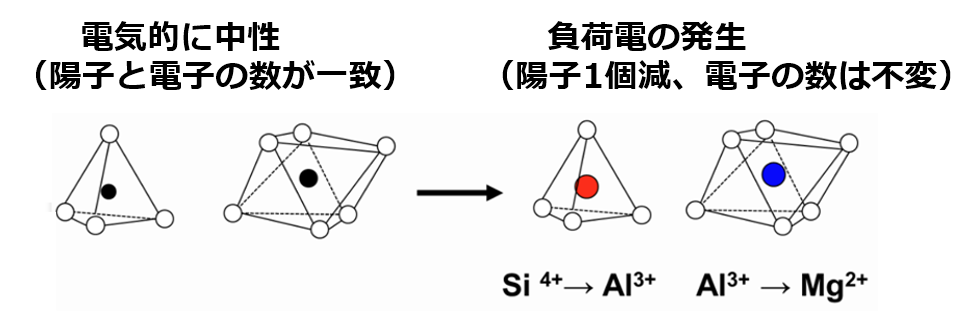
これを同形置換による『永久荷電』と呼び、
これにより、陽イオンを持つ他の養分(カルシウムCa²⁺、カリウムK⁺、マグネシウムMg²⁺等)を吸着できる。
この負電荷の存在は2:1層を次の2:1層へ結び付ける重要な役目を持つ。
即ち、2:1型層状ケイ酸塩鉱物はその負電荷分だけの陽イオンを吸着して
層間陽イオンとして層間に入り、
クーロンの力で上下の層を結び付ける。
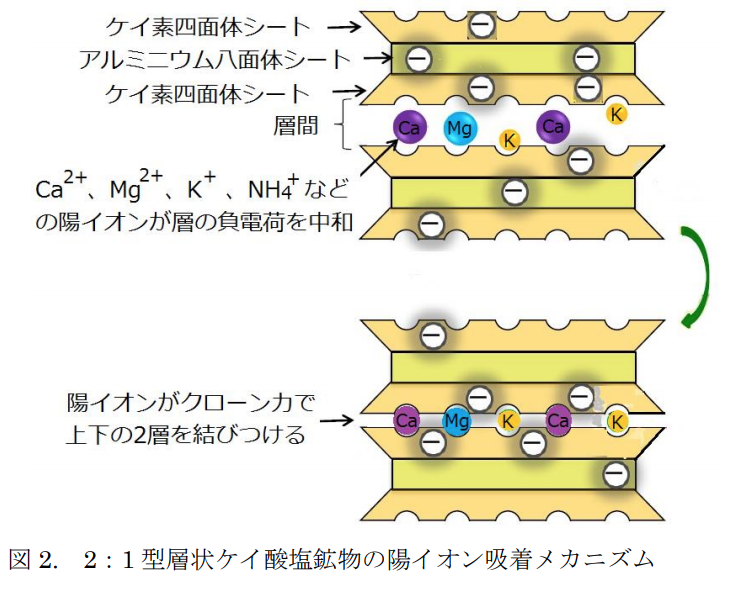

この吸着能力はCEC(陽イオン交換容量)といわれる。
CECが大きいほど、養分を多く蓄えられる事を示す。
CECは、土壌の吸着養分の指標として用いられ、施肥設計を考える上での基礎になっている。
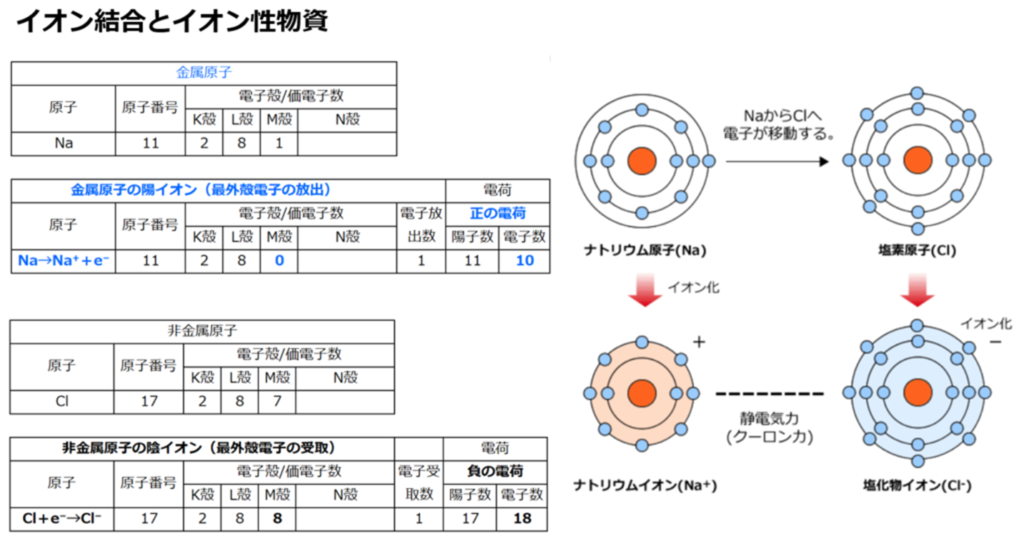
◆負に帯電する粘土鉱物
粘土鉱物のもう一つの荷電は
pH依存荷電(変異荷電)と呼ばれ、結晶構造の『末端』で生じる。
アルミニウムシート(Al³⁺)やケイ酸シート(Si⁴⁺)は、
鉱物端末に水酸基(OH)を有しており、
pHの上下に応じて、水素イオン(H⁺)の出入りが生じる。

水素イオン(H⁺)はプラスに帯電しているので、
pH上昇時(アルカリ条件)では水素イオン(H⁺)の放出により、粘土鉱物(ケイ酸シート(Si⁴⁺))はマイナスに帯電する。
-SiOH → -SiO⁻ + H⁺
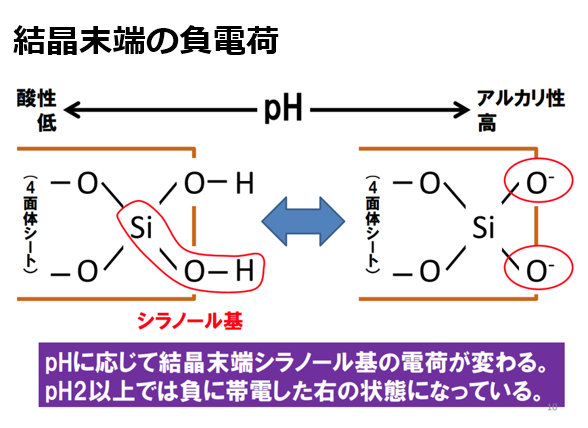
pH下降時(酸性条件)では水素イオン(H⁺)が引き付けられ、粘土鉱物(アルミニウムシート(Al³⁺))はプラスに帯電する。
-AlOH + H⁺ → -AlOH₂⁺
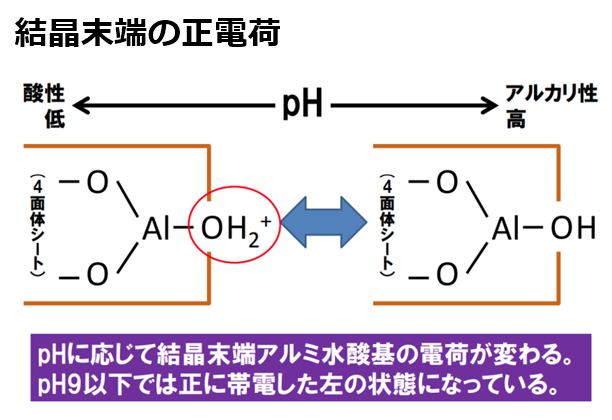
pH依存荷電(変異荷電)は
粘土鉱物に電気的特性(正負に帯電)をもたらすと同時に、PHの変化を和らげる緩衝作用がある。(増加した土壌溶液中のH⁺(水素イオン)を吸収して、H⁺(水素イオン)の急激な低下を防ぐ)
1:1型粘土鉱物であるカオリン質土壌では
H⁺(水素イオン)の増加やOH⁻(水酸イオン)の増加の影響が、直線に近い形でpHの値に現れる。
一方、アロフェン質土壌では、
pHの変化要因(水素イオンの増加等)に対する緩衝作用があり、酸性化に強い土壌である事が分かる。
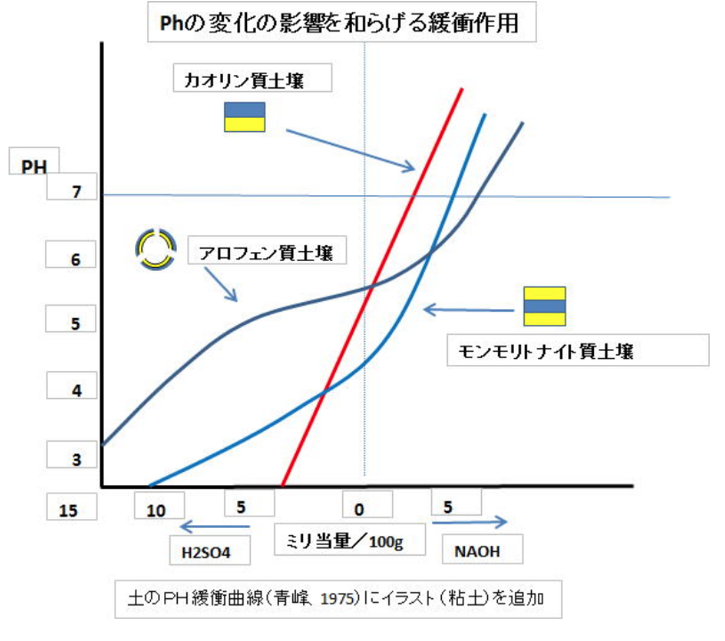
◆土壌pH値の管理
土壌が持つpH依存電荷は、粘土鉱物と腐植の両方に存在している。
いずれもpHが低下すると(土が酸性に傾く)と、保肥力は低下する。
1:1型粘土鉱物は、この『pH依存電荷』のみ有し、
2:1型粘土鉱物が有する『永久荷電』よりも劣っており、
土壌は相対的に地力の低い、痩せた土壌であると言える。
◆pHとは
・溶液中の水素イオン(H⁺)濃度をいう。
水は分子式H₂Oで表されるが、100% H₂O分子のままで存在しているのではなくて、必ず水素イオン(H⁺)と水酸イオン(OH⁻)が解離している。
H₂O↔H⁺+OH⁻
解離の数値は両者が中性で10⁻⁷。
水分子が10,000,000有る中で1イオン存在する数値である。
両者のイオン濃度を掛け算すると10⁻⁷×10⁻⁷=\(10 ^ {-14}\)になる。
注:指数法則より\(a ^ {m} \ ×\ a ^ {n} = a ^ {m + n}\)
この数値を水のイオン積といい、水素イオンの濃度に関わらず一定の数値(\(10 ^ {-14}\))を示す。
水素イオンの濃度が\(10 ^ {-4}\)なら水酸イオン\(10 ^ {-10}\)、水素イオンの濃度が\(10 ^ {-9}\)なら水酸イオン\(10 ^ {-5}\)で、両者イオン濃度の積は常に\(10 ^ {-14}\)。
両者は反比例している。
PH(power of hydrogen)は
水素イオン濃度表記の(\(10 ^ {-x}\))から、(\(10 ^ {-}\))をとって、ただ単に「PHX」と簡潔にする表記。
水素イオン濃度\(10 ^ {-5}\)はPH5、水素イオン濃度\(10 ^ {-6}\)はPH6と表記。
PHの数値が一つ違うと水素イオン濃度は10倍違う。
PH7は中性、7以下を酸性、7以上をアルカリ性と呼んでいる。