このセクションでは高校化学・物理で記載されている内容に基づいている。
最初に敢えて『高校』と明記した理由は、
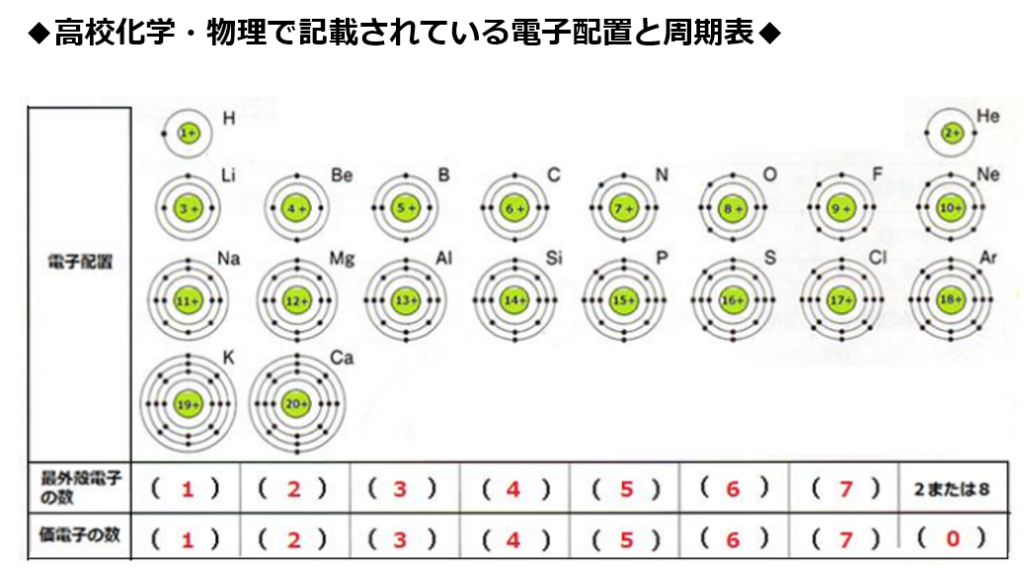
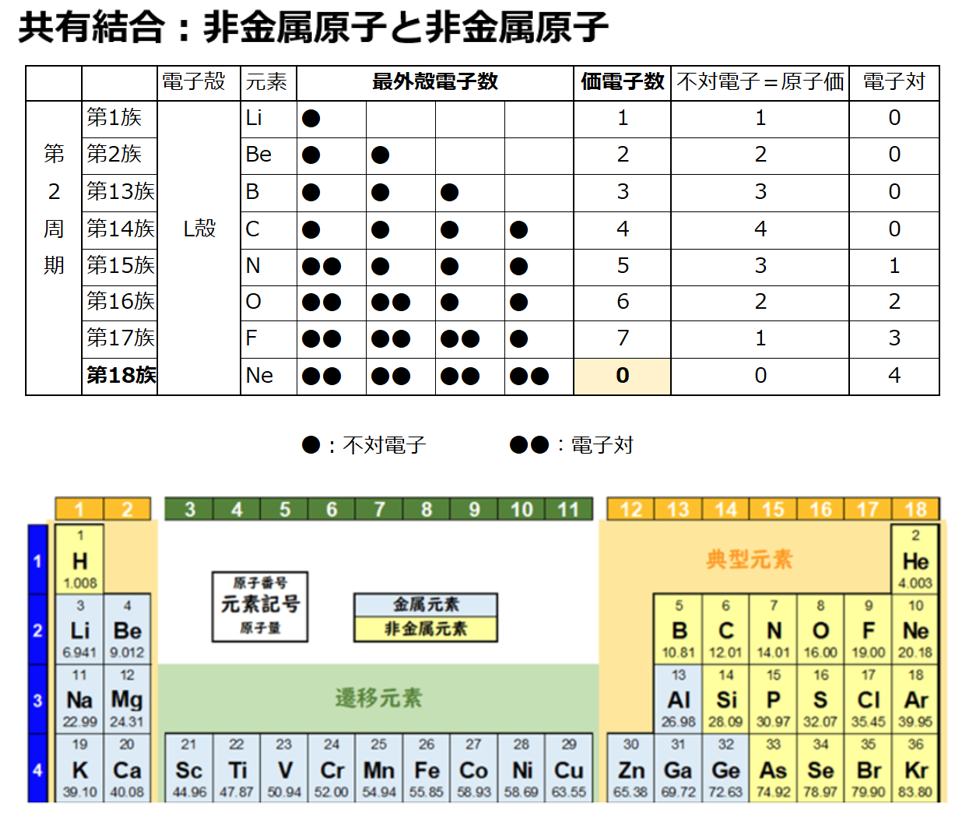
希ガス(貴ガス)の価電子はゼロであると多くの高校生向け書籍等(例:NHK高校講座化学基礎第8回電子殻と電子配置 第18族価電子数ゼロ)で記載されているからである。
だがこの考え方は
希ガス(貴ガス)の化合物が知られていなった古い時代の考え方である。
現在の国際的な慣習では、
希ガス(貴ガス)を含めて、原子の最外殻電子と価電子を同一視する。
注:上記見解は名城大学理工学部応用化学科 有機化学基礎 講義資料 第1章『電子構造と共有結合(1)より転記。
https://www2.meijo-u.ac.jp/~tnagata/education/ochemb/2019/ochemb_01.pdf
■『高校化学・物理』と『量子化学・量子力学』について
・明確な違いとして量子化学・量子力学では新たに『スピンの概念』が導入されている。
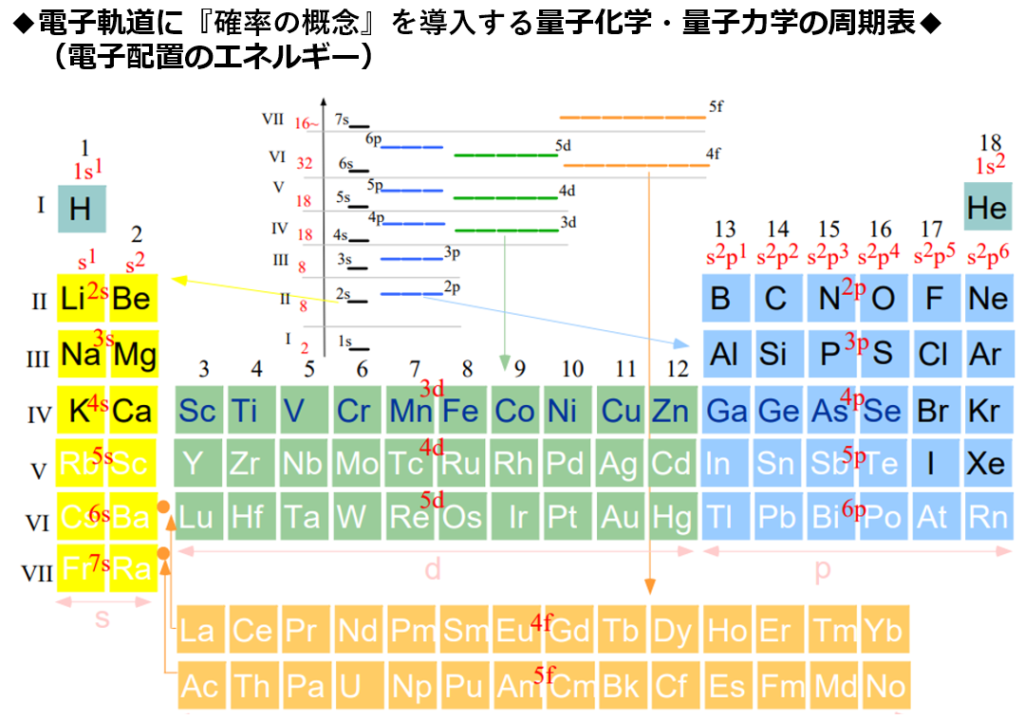
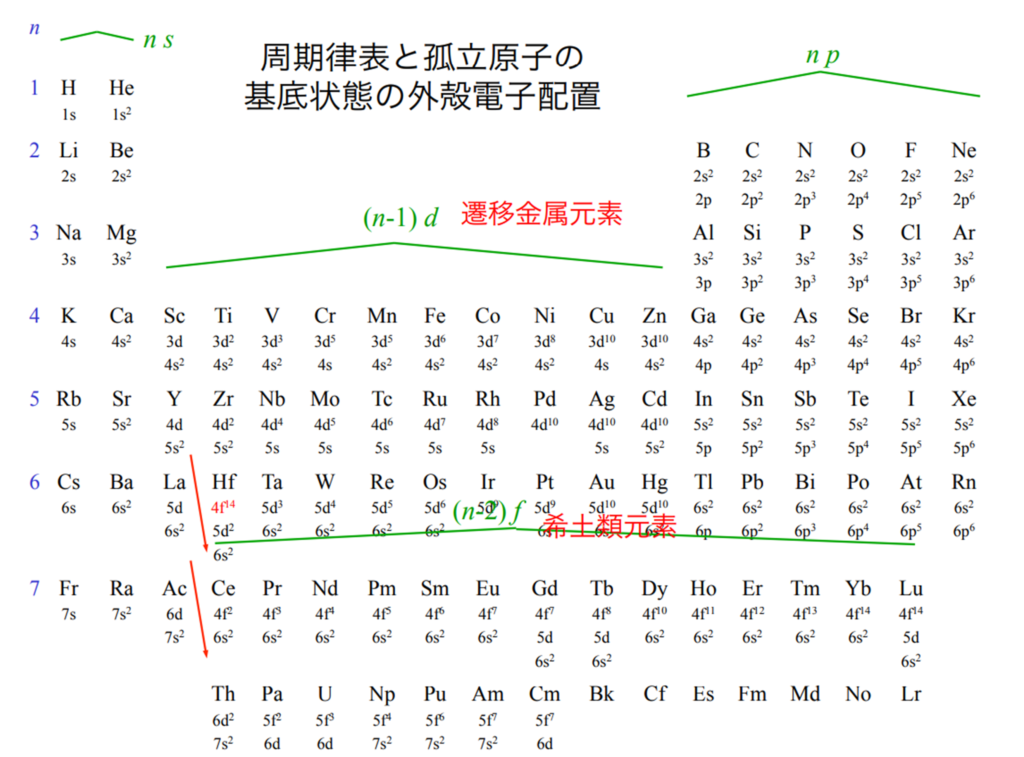
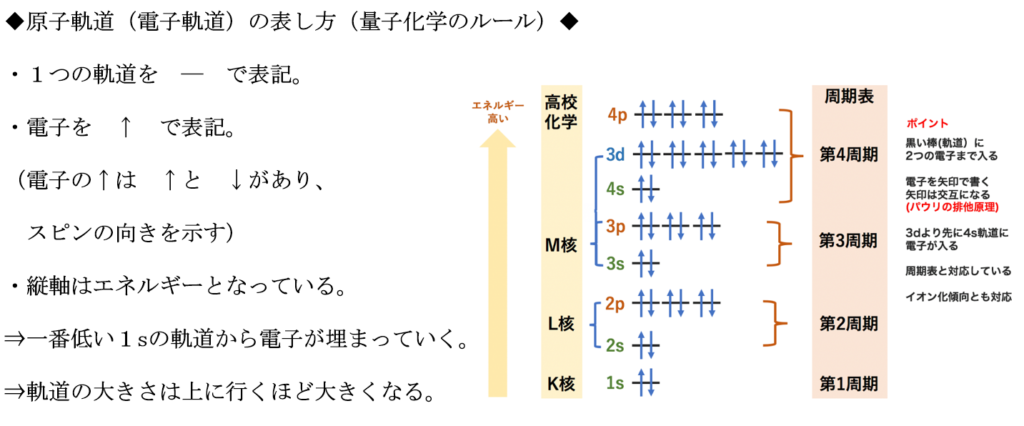
原子軌道が原子核に近くなるほど、エネルギーは低くなる。
1s軌道から3d軌道までの原子軌道のエネルギー順序は1s<2s<2p<3s<3p<4s<3d
電子は、エネルギーが低い程、安定であると呼ばれる。
エネルギーの高い電子は、
そのエネルギーを他の電子に渡して、より安定な状態に移ろうとする。
従って、原子や分子が化学反応を起こそうとする原動力は、
それらを構成している電子がより安定な状態(エネルギーの低い状態)に変化しようとする事である。
注:名城大学理工学部応用化学科 有機化学基礎 講義資料 第2章『電子構造と共有結合(2)より転記。
以下、高校化学・物理が提示する世界観のツアーに出かけよう。
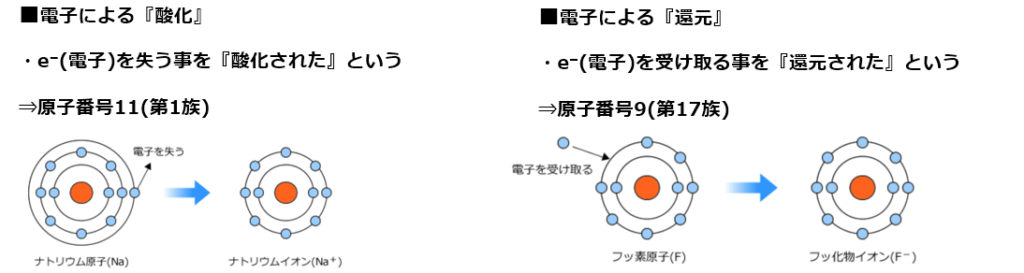
■酸化還元反応
・2種類の物資間で『酸素』、『水素』、『電子(e⁻)』の授受が同時に起こる化学反応。
・酸化:物質が酸素を得る、又は水素を失う反応、又は電子を失う事。
・還元:物資が酸素を失う、又は水素を得る、又は電子を受け取る事。
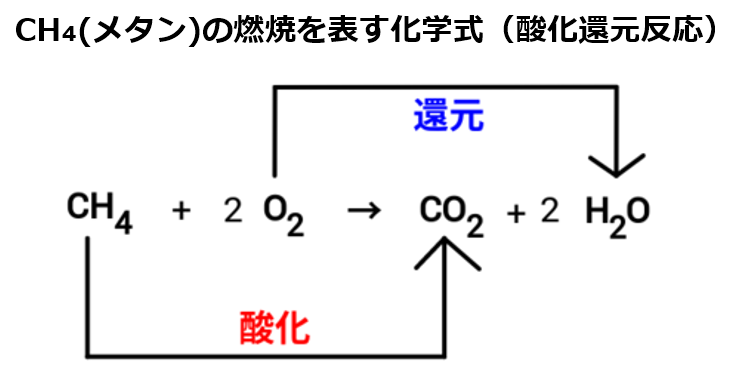
最初に、この反応の前と後で『炭素原子C』を含む物資に注目する。
反応前:CH₄
反応後:CO₂
・水素と化合していた炭素は、水素を失い、酸素と化合している
⇒酸化:物質が酸素を得る、又は水素を失う反応
次に、この反応の前と後で『酸素原子O』に注目する。

反応前:O₂
反応後:H₂O
・酸素は水素を得ている
⇒還元:物資が酸素を失う又は水素を得る
◆何かが水素を失った時、必ず別の何かが水素を得ている。酸素も同様である。
ある物資が酸化された時、他に還元された物資が存在する。
『酸化』と『還元』はセットで起こる現象である。
■■酸化還元反応の本質
・酸化還元反応の本質は原子同士で電子を受け渡す反応である。
2Cu + O₂ → 2CuO
を電子式で表現すると
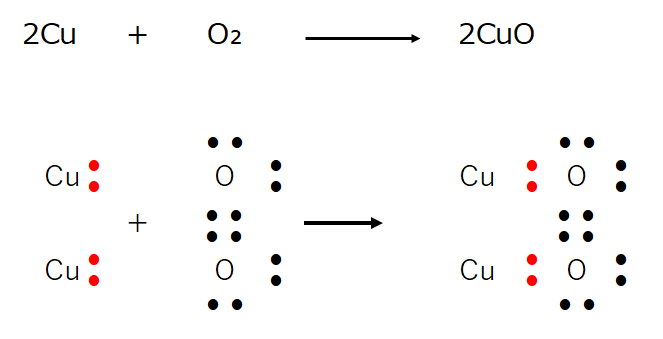
この現象を電子の授受の観点から眺めると、ここで生成した酸化銅はイオン結合(金属原子と非金属原子の結合)の物質である。
銅が電子(2e⁻)を放出し(与える)、酸素が電子(2e⁻)を受取っている。
銅は電子(2e⁻)を放出(与えた)した結果、陽イオンCu²⁺になる。
⇒イオンにおける酸化数は+2。
一方、酸素は電子(2e⁻)を受取った(=奪った)ので陰イオンO²⁻になる。
⇒イオンにおける酸化数は-2。

上記イオン表記を分子表記にすると
2Cu + O₂ → 2CuO

■酸化数より酸化・還元を導く
・酸化数が増加⇒酸化された
・酸化数が減少⇒還元された
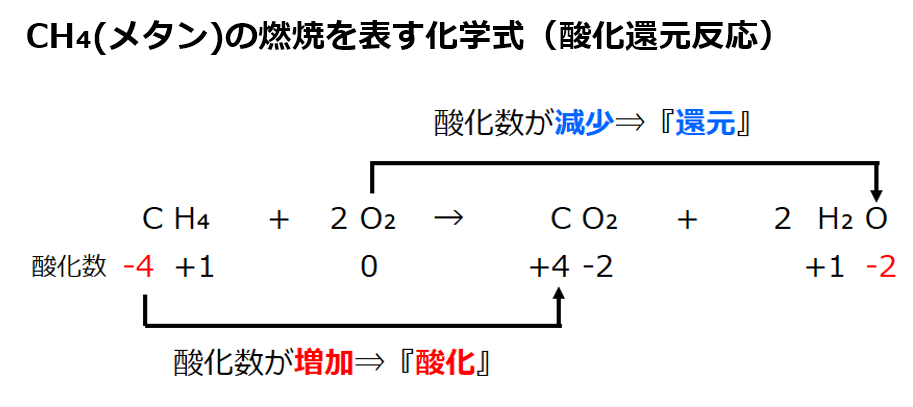
・酸化数のルールより
CH₄のCの酸化数は-4(ルール②と③)、CO₂のCの酸化数は+4(ルール②と③)。酸化数は-4から+4に増加。
⇒酸化された原子はCである。
・2O₂のOの酸化数は0(ルール①)、2H₂OのOは酸化数が−2(ルール②と③)。酸化数は0から-2に減少。
⇒還元された原子はOである。

■酸化数を理解して半反応式(=電子(e⁻)の移動を表した式)を作る
<事例1:酸化数を決めるルール①と④より>
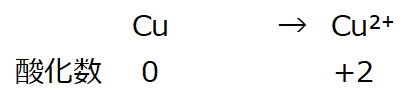
酸化数:左辺0(ルール①)、右辺+2(ルール④)。
左右で釣り合いが取れていない。電荷をゼロにする。
半反応式

右辺に2e⁻を付加すると、左辺:0、右辺:+2+2e ⁻(=-2)=0
左右が釣り合う。電荷はゼロになる。
<事例2>

酸化数:左辺0(ルール①)、右辺-1(ルール④)。
左右で釣り合いが取れていない。電荷をゼロにする。
半反応式
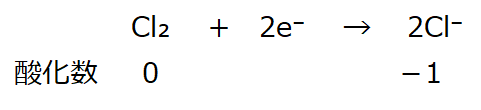
左辺に2e⁻を付加すると、左辺:2e⁻(=-2)、右辺:-2
左右が釣り合う。電荷はゼロ。
<参考:イオン&イオン結合>
■■酸化剤・還元剤
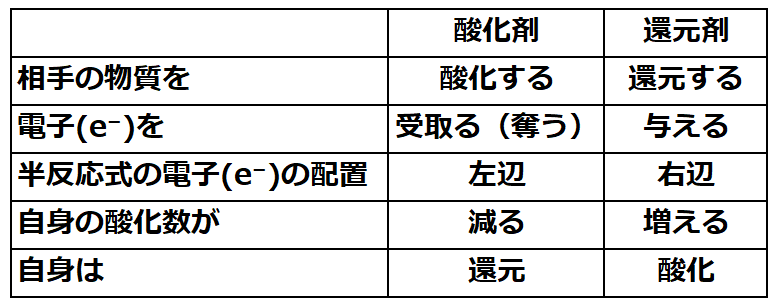
・半反応式を使う事で酸化・還元が説明しやすくなる。
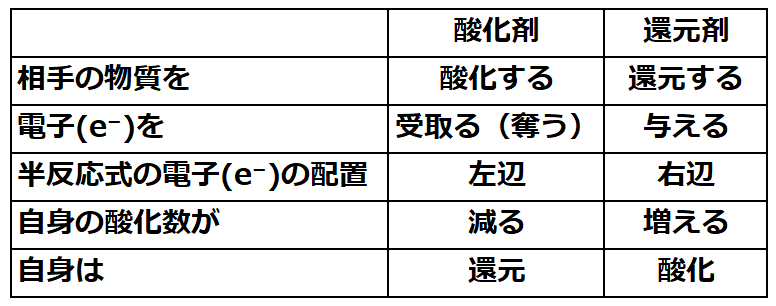
・酸化剤と還元剤の半反応式での電子e⁻の位置は
⇒【酸化剤:半反応式の左辺に電子(e⁻)を配置】
⇒【還元剤:半反応式の右辺に電子(e⁻)を配置】
■酸化剤とは

酸素(O)にて酸化されるのでOの酸化数に注目する
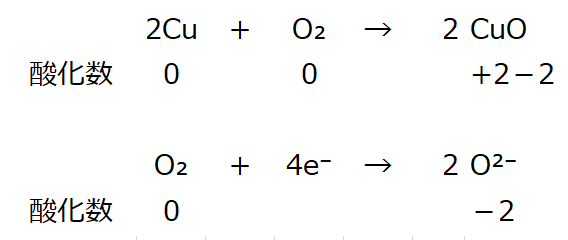
O₂は電子(4e⁻)を受け取り、O²⁻に酸化している。
⇒【酸化剤:左辺に電子(e⁻)を配置】
O₂は酸化剤であり、O₂自身は酸化数を減少(0→-2)なので『還元している』。
◆酸化剤の特徴(O₂)
・相手の物資を酸化する
・電子を受け取る(奪う)
・自身の酸化数が減る⇒『還元している』
■還元剤とは

硫黄(S)の酸化数が変化している。硫化水素を取り出し
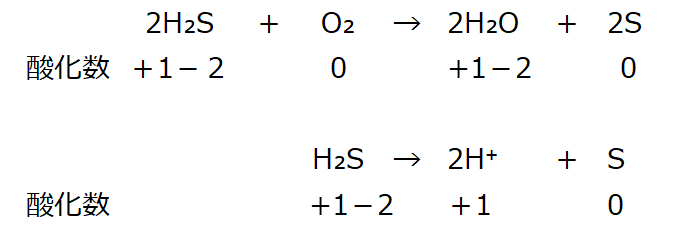
酸化数:左辺が0、右辺が+2で釣り合いが取れていない。電荷をゼロにする。
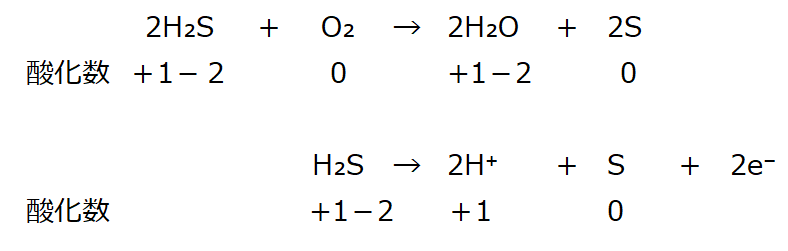
右辺に電子(2e⁻)を付加し、左右を釣り合わせる。電荷はゼロになる。
H₂Sは電子(2e⁻)を与え、Sを還元している。
⇒【還元剤:半反応式の右辺に電子(e⁻)を配置】
◆還元剤の特徴(H₂S)
・相手の物資を還元する
・電子を与える
・自身の酸化数が増える(-2から+0)⇒『酸化している』
■■『過マンガン酸カリウムの硫酸酸性溶液』と『過酸化水素水』の酸化還元反応
酸化還元反応式を作る手順
1.半反応式の作成(電子(e⁻)を含む反応式)
2.イオン反応式の作成(酸化剤の半反応式と還元剤の半反応式から電子を消去する)
3.酸化還元反応式の作成(イオンが余らないように、反応に関係しないイオンを加える)
■1.半反応式の作成(電子(e⁻)を含む反応式)
KMnO₄のH₂SO₄水溶液とH₂O₂の酸化還元反応式を作成
強力な酸化力を持つMnO₄⁻が酸化剤となり、H₂O₂が還元剤になる。
それ以外のイオンK⁺、H⁺、SO₄²⁻は、とりあえず無視する。
1.反応前と反応後の化学式を書く(覚える必要有)
MnO₄⁻→Mn²⁺
2.両辺のO原子の数を『H₂O』を使って揃える
左辺O₄より右辺に4H₂Oを付加
⇒MnO₄⁻→Mn²⁺+4H₂O
注:酸化剤・還元剤どちらの場合も、O原子の数が揃っている場合は足す必要はない。
3.両辺のH原子の数をH⁺(陽イオン)で揃える
右辺4H₂より左辺に8H⁺(=4×2)を付加
⇒MnO₄⁻+8H⁺→Mn²⁺+4H₂O
4.両辺の電荷(プラスとマイナス)の数をe⁻を使って総電荷数を揃える
電荷の調べ方は、各辺についている⁺または⁻の数を数える。
左辺の電荷:MnO₄⁻についている『⁻』と8つのHにそれぞれひとつずつついている『⁺』で計+7
右辺の電荷:Mnについている²⁺により計+2
よって左辺の方がプラスの電荷を5個(左辺+7、右辺+2)多く持っているため、5個のe–を付加して両辺電子の持つ電荷(酸化数)を0にする。
⇒MnO₄⁻ + 8H+ +5e⁻→Mn²⁺+4H₂O
以上でMnO₄⁻の半反応式が完成。
酸化剤である事が判明した。
⇒【酸化剤:半反応式の左辺に電子(e⁻)を配置】
尚、酸化数を利用して半反応式の作成方法も紹介する。
1.反応前と反応後の化学式を書く(覚える必要有)
MnO₄⁻→Mn²⁺
手順①:酸化数が減少した分だけ、電子(e⁻)を左辺に書き加える(酸化剤は電子を受取る)

Mnの酸化数+7から+2に減少。減少数は-5。故に電子(5e⁻)を左辺に書き加える。
手順②:左辺と右辺の電荷数が等しくなるように、H⁺を左辺に書き加える。

左辺の電荷数-6、右辺の電荷数+2。左辺に陽電子8H⁺を書き加える。
手順③:左辺と右辺の原子数が等しくなるように、右辺にH₂O書き加える事が多い。

左辺の原子(H)数8、右辺の原子(H)数8にする為に4H₂Oを書き加える。
・還元剤の半反応式を作る
還元剤である 過酸化水素H2O2 が O2 に変化する過程の半反応式
1.反応前と反応後の化学式を書く
H2O2 →O2
2.両辺のO原子の数を『H₂O』を使って揃える
⇒H2O2 →O2
左辺と右辺共にO₂を持っているのでそのままの形で良い。
注:酸化剤・還元剤どちらの場合も、O原子の数が揃っている場合は足す必要はない。
3.両辺のH原子の数をH⁺(陽イオン)で揃える
左辺のHの数は2個、右辺のHの数は0個
よって右辺にH⁺を2個追加する。
⇒H2O2 →O2 +2H⁺
4.両辺の電荷(プラスとマイナス)の数をe⁻を使って揃える
左辺の電荷:H2O2は電荷がゼロ。
右辺の電荷:O2 +2H⁺においてO2 は電荷がゼロ。2H⁺のみが電荷+1ずつ、計+2である。
右辺にe⁻を2つ加える事で電荷を0にする。
H2O2 →O2 +2H⁺+2e⁻
以上でH2O2の半反応式の完成。
◆酸化剤と還元剤の半反応式での電子e⁻の配置
【酸化剤:左辺に配置】MnO₄⁻→Mn²⁺
MnO₄⁻ + 8H+ +5e⁻→Mn²⁺+4H₂O
【還元剤:右辺に配置】H2O2 →O2
H2O2 →O2 +2H⁺+2e⁻
■2.イオン反応式の作成(酸化剤の半反応式と還元剤の半反応式から電子を消去する)
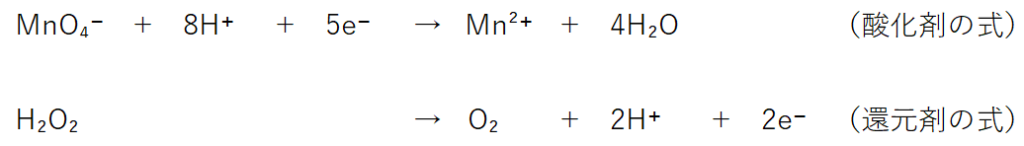
両式から電子(e⁻)を消す為に、酸化剤の式×2、還元剤2の式×5にする。

■3.酸化還元反応式の作成(イオンが余らないように、反応に関係しないイオンを加える)
1.で無視した(直接反応に関係しない)イオンK⁺とSO₄²⁻を両辺に加えて、イオンをなくせば、酸化還元反応式になる。
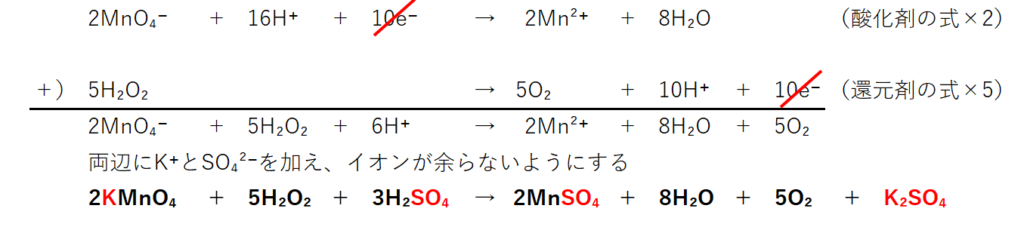
左辺のMnO₄⁻、H⁺に着目してイオンK⁺とSO₄²⁻を加えて、左辺からイオンを無くす。
2個の陽イオンK⁺と3個の陰イオンSO₄²⁻を左辺に加え、2KMnO₄にする。
次に同数のイオンを右辺にも加える必要がある。
2Mn²⁺には陰イオンSO₄²⁻を2個組み合わせれば良い。
残った2個の陽イオンK⁺と1個の陰イオンSO₄²⁻を組んでK₂SO₄にする。
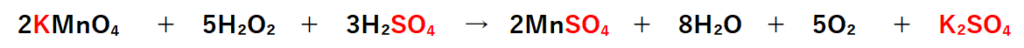
これで酸化還元反応式が完成。
■■まとめ:酸化還元反応とは?■■
酸化還元反応は酸化と還元に分けられる。
酸化と還元が同時に起こる反応が酸化還元反応である。
・酸化:ある物質が酸素と化合して、水素を奪われる事、又は電子を失う事。
・還元:ある物資が酸素を奪われて水素と化合する事、又は電子を受け取る事。
◆酸化と還元の概念には2つ考え方がある。
①酸素と水素のやり取りで考える概念。
・全ての反応式に対応できる概念ではなく、反応式内に酸素や水素がある場合にのみ対応出来る。
2CU+O₂→2CUO
CU(銅)は左辺では酸素を持っていなが、右辺では酸素をもっている。
酸素と化合したという事はCUは酸化された事になる。
逆に酸素はCUに酸素を奪われているので還元されている。
H₂S+Cl₂→2HCl+S
Cl₂(塩素)は左辺では水素を持っていないが右辺では水素を持っている。
Clは水素と化合した事になり、Cl₂は還元された事になる。
逆にH₂S(硫化水素)は水素を奪われているので酸化された事になる。
②電子のやり取りで考える概念。
既に説明済み。
以下にて『電子』に関する知識を復習する。
1.原子の性質
①化学変化によって、それ以上分ける事が出来ない。
②化学変化によって、新しくできたり、別の原子に変わったり、なくなったりしない。
③種類によって、大きさや質量が決まっている。
【原子の構造】
・原子の中心には、正の電荷を持つ『原子核』がある。
そして、原子核の周りには、負の電荷を持つ『電子』が回転しながら取り巻いている。
原子=原子核+電子
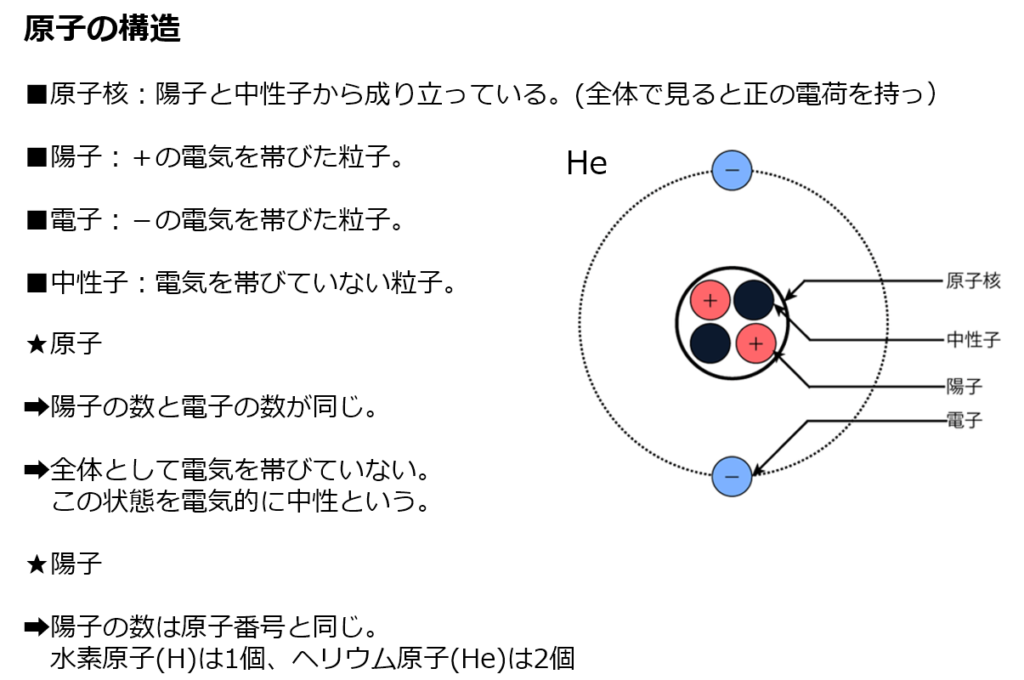
・原子が持つ陽子(+の電気を帯びた粒子)の数は、原子の種類毎に決まっている
例えば原子番号6番の炭素原子(C)であれば、6個の陽子を持つ。
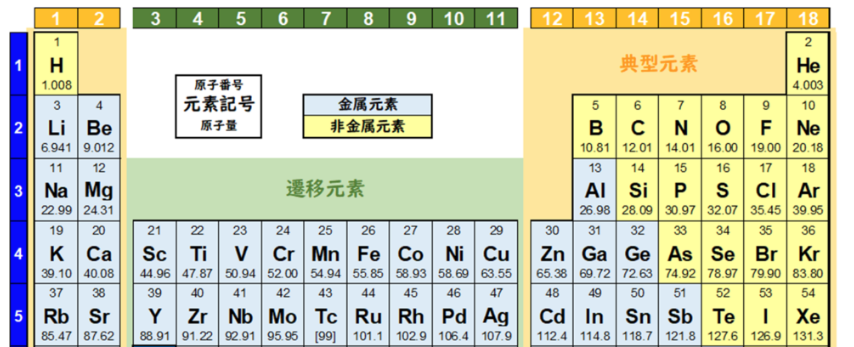
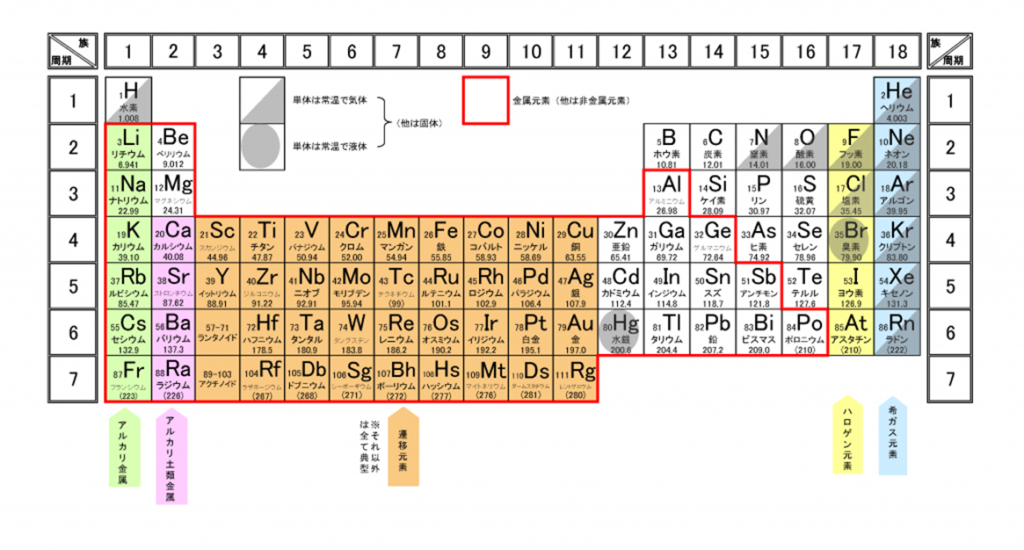
元素周期表では、色々な元素が、陽子の数に基づいて順番に並べられている。
故に、原子番号と陽子の数は一致する。
現在知られている原子は、水素(H)原子や酸素(O)原子等118種類。
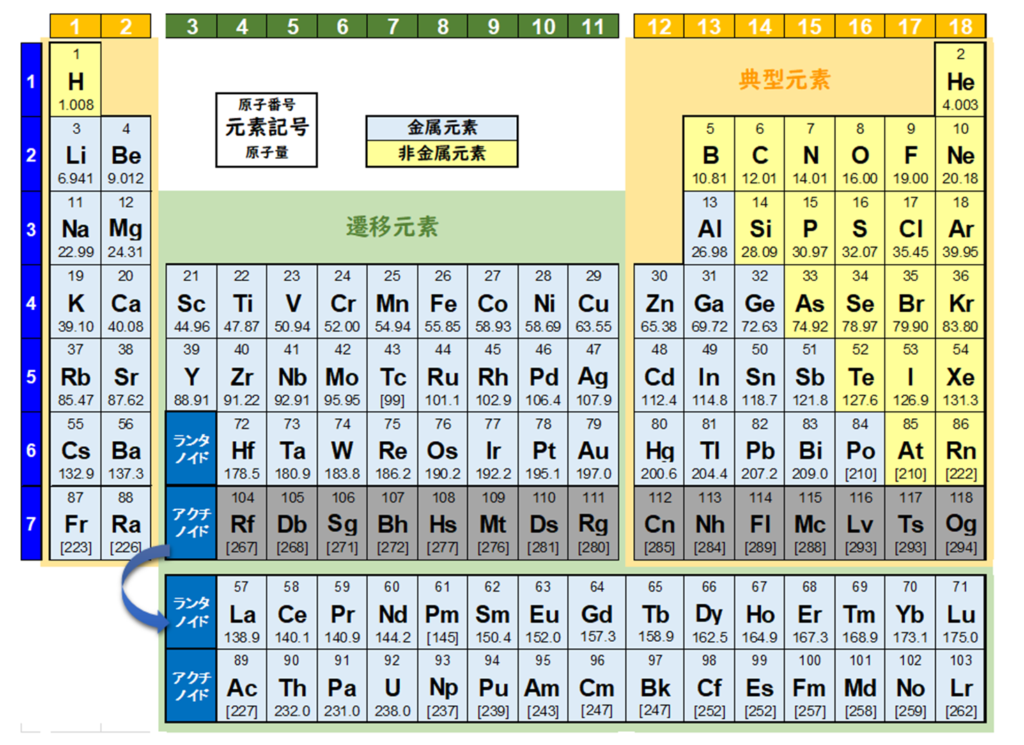
元素を原子の質量(原子量)順に並べた周期表を下記に記載する。
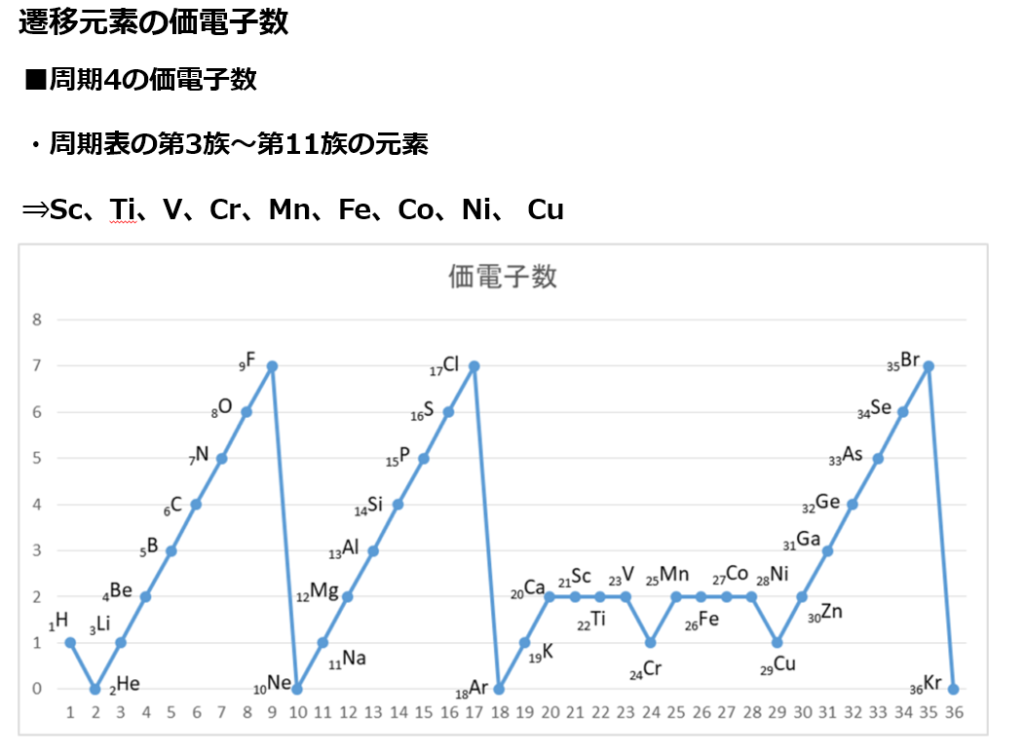
原子番号の増加にともなって価電子の数が周期的に変化する原因は、原子の電子配置と元素の性質が深く関わっている事が知られている。
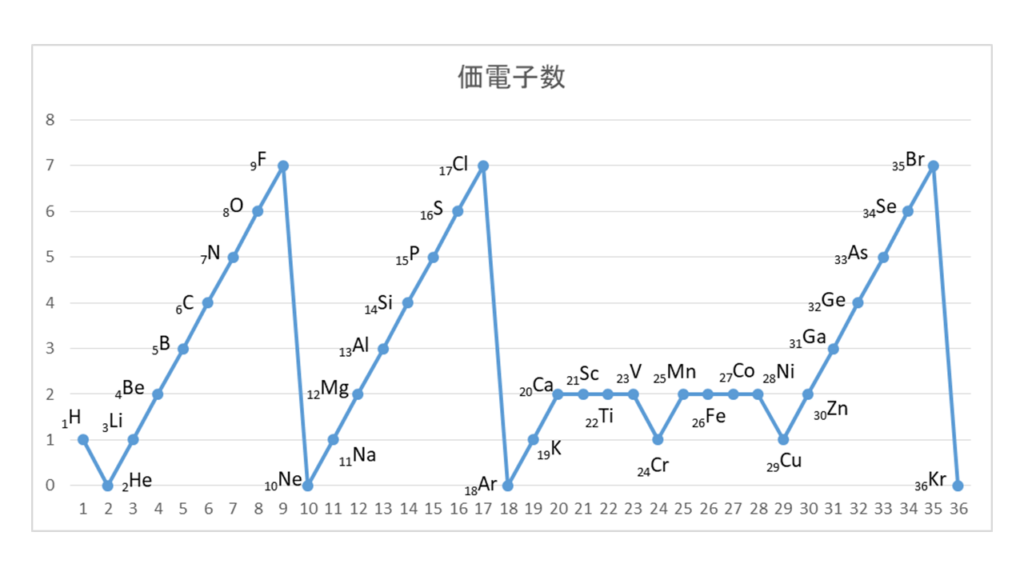
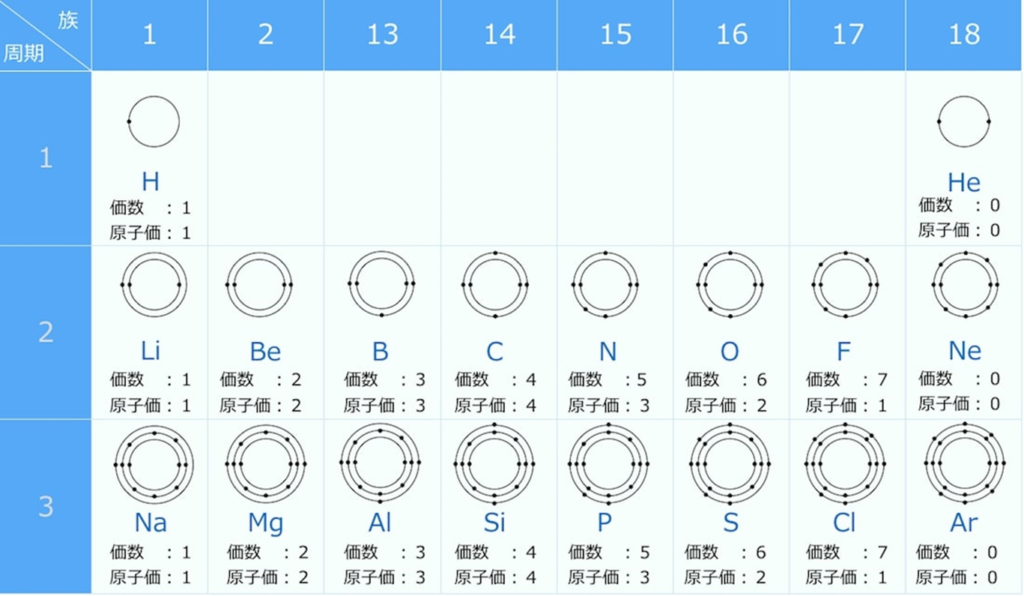
【原子価】
化学を学ぶ上で欠かせないのが『周期表』である。
周期表を見れば、その原子が持つ『原子価の数』は直ぐ分かる。
・原子価の数のルール
周期表の縦列(縦軸)に沿って同じ数を持つようになっている。
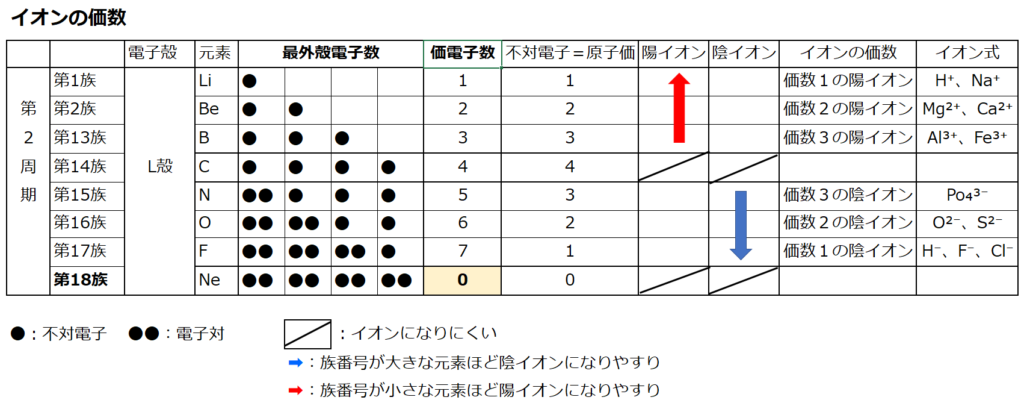
第1族の原子価は1個、第2族の原子価は2個、第13族の原子価は3個、第14族の原子価は4個
第15族の原子価は3個、第16族の原子価は2個、第17族の原子価は1個、第18族の原子価は0個
第14族をピークに原子価は逆に1個づつ減っていき、第18族の希ガスでは0個になる。

原子価=不対電子の数
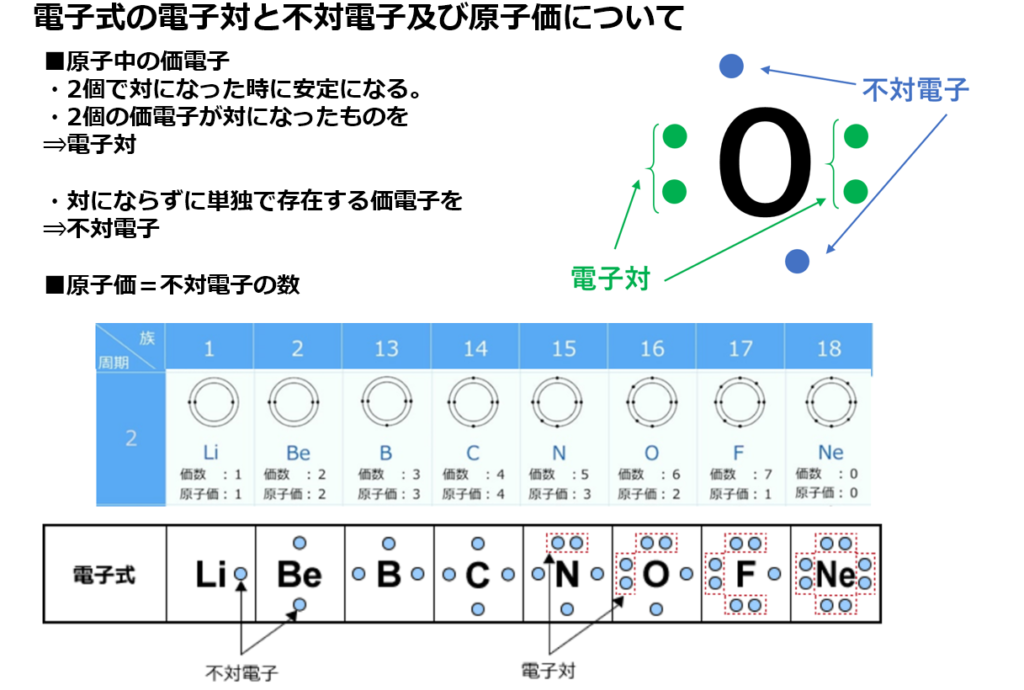
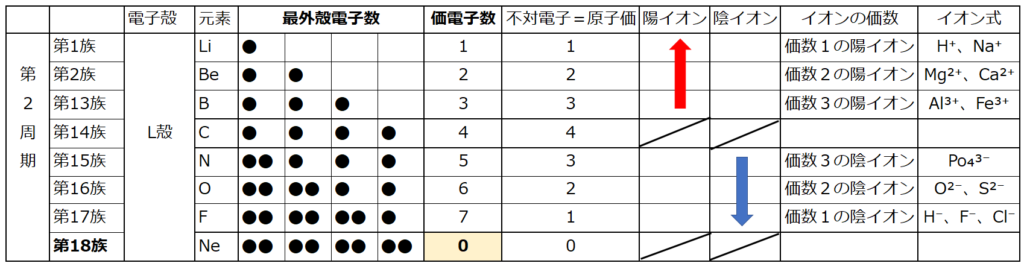
原子価を理解する為に価電子の数に注目する。
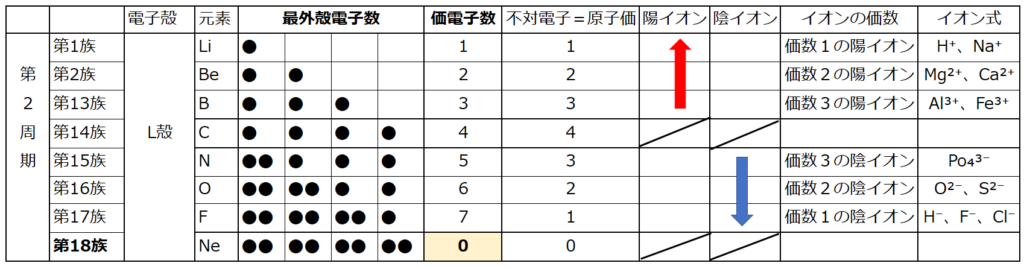
【価電子数(=価数)】
・価電子とは
原子の最外殻にある電子の事である。
最外殻電子は化学反応に寄与する電子なので、
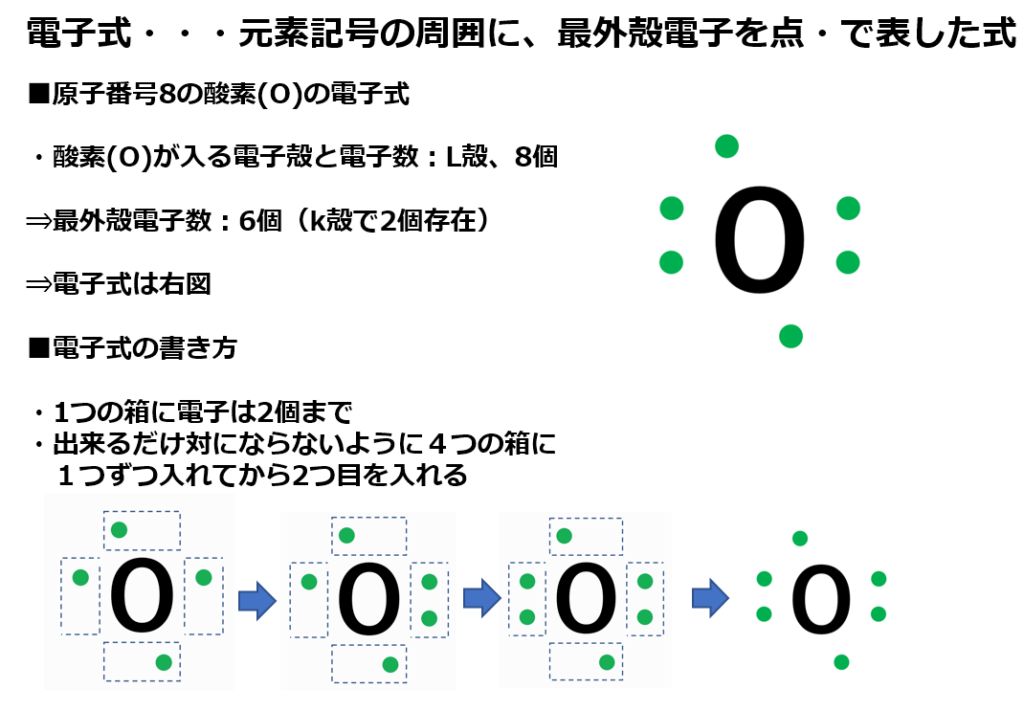
元素記号の周りに最外殻電子を・で表す書き方がある。
例えば、原子番号7番の窒素(N)の電子式は下図になる。

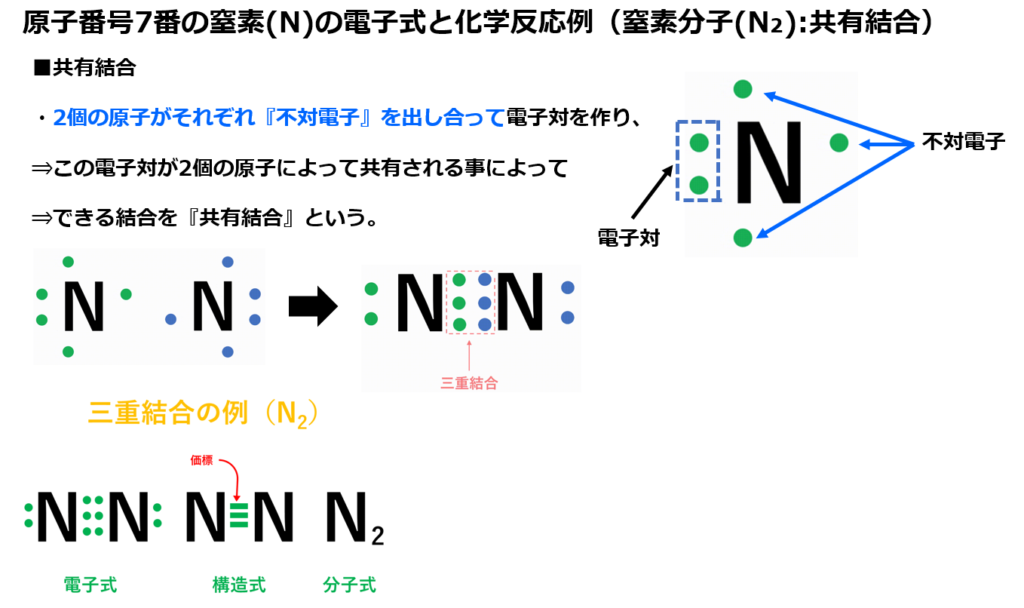
下図にて原子番号7番の窒素(N)の電子配列を示す。

・原子は最外殻電子が8個(この状態をオクテットと言う)又は一杯になった状態(この状態を閉殻と言う)が最も安定している。
どの原子も安定な状態を目指して『電子のやり取り』をする。
周期表の左端にある2周期と3周期の族番号1は価電子が1個、2族は2個、13族は3個、14族は4個、15族は5個、16族は6個、17族で7個、18族である希ガスは8個の電子を持つ。


注:オクテットの考え方は第3周期までしか利用できない。(オクテット=「原子の最外殻電子の数が8個あると化合物やイオンが安定に存在する」という経験則)
【原子価と価電子の数との関係】
原子価とは、原子が結合できる数の事を意味する。
結合できる数とは、
不対電子の数になるので、
原子価=不対電子の数と求める事ができる。
これが原子価の求め方になる。



【価電子数(=価数)】
・閉殻とは
各電子殻(K殻、L殻、M殻、N殻、…)が最大数の電子で満たされた状態。
この時、原子は非常に安定的になる。
原子番号18番の元素であるAr(アルゴン)ではM殻(定員18個)に8個の電子が入った状態である。
つまり、周期表の一番右に該当する『第18族(=縦18列目)の希ガス(He、Ne、Ar・・)』は安定的で、他の原子と反応しない。
ヘリウム(He)はK殻(2個)が埋まった状態、ネオン(Ne)はK殻(2個)とL殻(8個)が埋まった状態である。
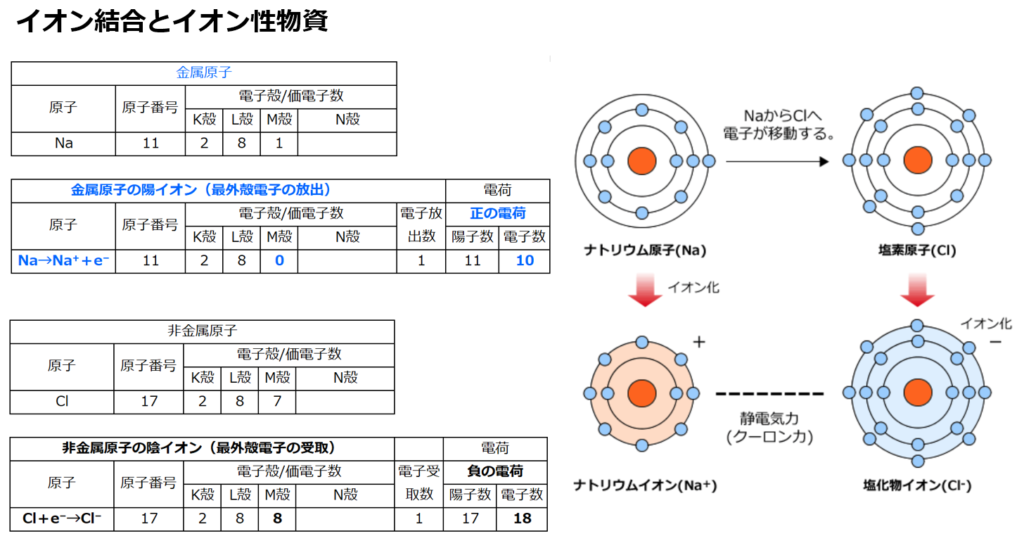
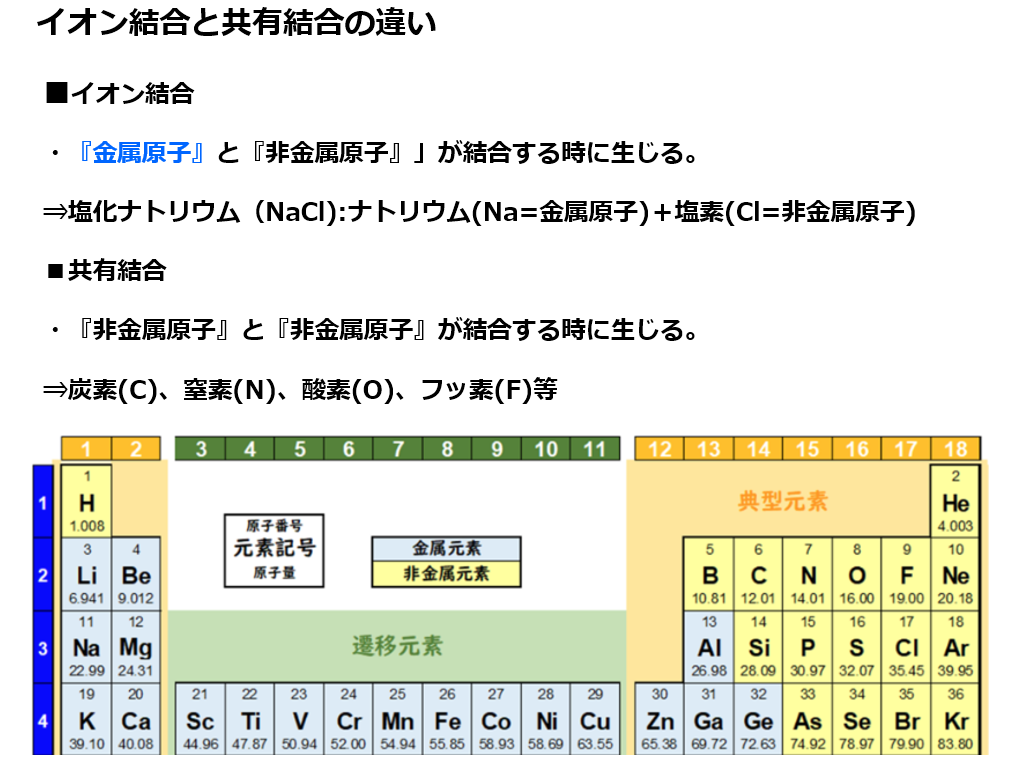
■イオン結合
原子は『安定した状態』を目指し『電子のやり取り』をする。
単体(原子1種類で出来ている物資)の『気体(=非金属原子)』である原子番号17番の塩素(Cl)のみや『金属原子』である原子番号11番のナトリウム(Na)のみよりも、
『金属原子+気体(=非金属原子)』という化合物である塩化ナトリウム(NaCl)の方が安定している理由は
原子番号11番のナトリウム(Na)は第1族(=周期表の縦1列目)元素であり、安定している状態(オクテット:k殻の電子2個+L殻の電子8個=10個)に比べて電子が1個余っている。
電子を1つ他の元素に渡すと、安定出来る。
Na→Na⁺+e⁻
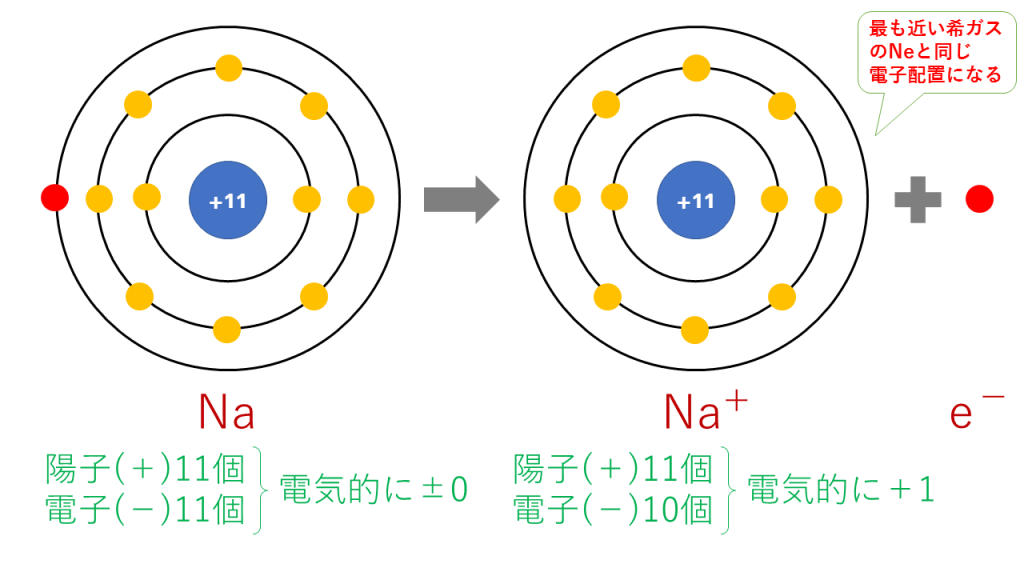
電子(e⁻)は負電荷を持つので、1つ電子を渡すとナトリウム(Na)は正電荷(陽子(+)11個、電子(̠−)11個−1個=10個)になり、ナトリウムイオン(Na⁺)になる。
注:原子は陽子と電子の数が一致しており、全体として電気を帯びていない。
注:原子番号=陽子の数=電子の数

原子番号17番の塩素(Cl)は第17族(=周期表の縦17列目)元素であり、安定している状態(k殻の電子2個+L殻の電子8個+M殻の電子8個=18個)に比べて電子が1個足りない。
つまり電子を1個もらえれば安定する。
Cl+e⁻→Cl⁻
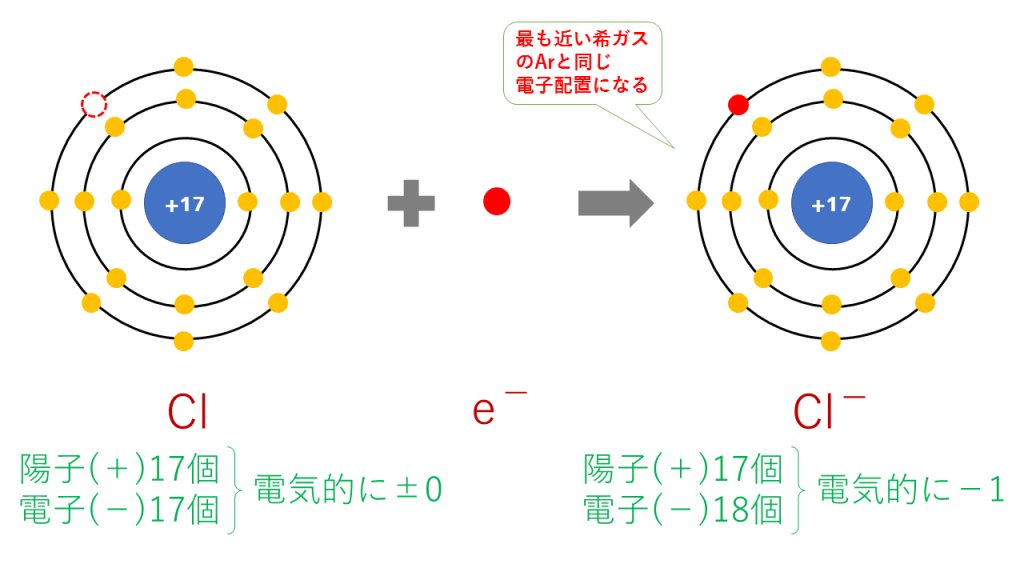
電子(e⁻)は負電荷を持つので、1つ電子を受け取ると塩素(Cl)は正電荷(陽子(+)17個、電子(̠−)17個+1個=18個)になり、塩化物イオン(Cl⁻)になる。
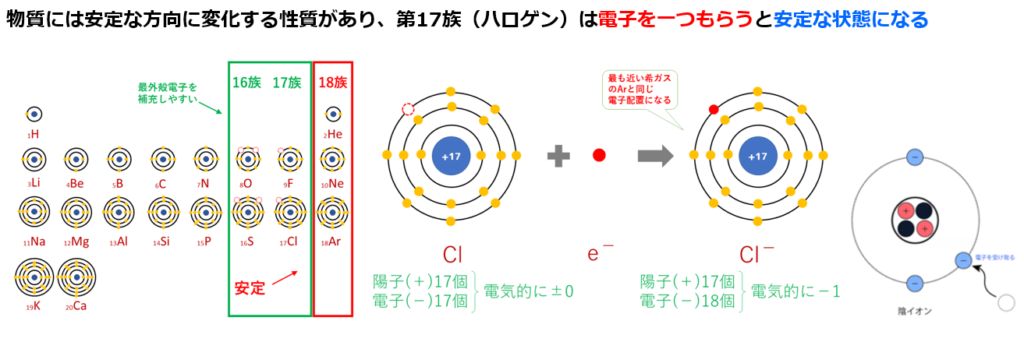
原子は陽子と電子の数が一致しており、全体として電気を帯びていないので、
塩素(Cl)が電子を1個受けると塩素(Cl)は負電荷(陽子(+)17個、電子(̠−)17個+1個=18個)になり、塩化物イオン(Cl⁻)になる。
1つの電子を渡したいNa⁺と
1つの電子を受けたいCl⁻
が結合する事で、塩化ナトリウム(NaCl)という安定した物資が出来る。
・塩化ナトリウム:NaCl
Na⁺の価数が+1、Cl⁻の価数が−1なので1対1で結合し、NaClになる。
イオンとは
原子が電子を放出したり取り入れたりして安定な電子配置となり,
その結果,+の電気と -の電気のつり合いがこわれて電気を帯びるようになったものがイオンである。
つまり,原子がイオンになるときには電子配置が変わり、その結果,もともと安定な電子配置をしている(Octet を満足している)原子と同じ 電子配置になる。
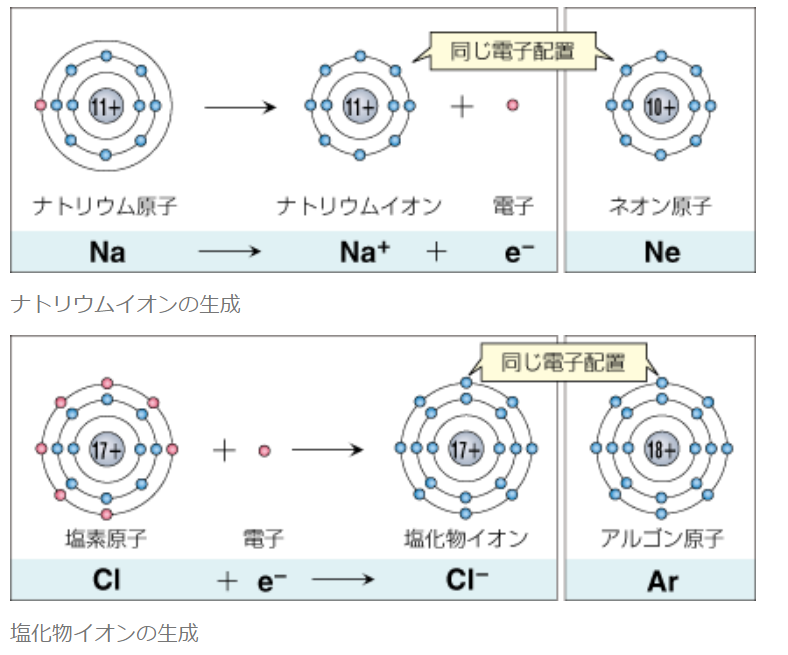
◆単原子イオン
原子からe⁻(電子)が取れる(放出する)とプラスに帯電し陽イオンに、
原子がe⁻(電子)を取り込む(受け取る)とマイナスに帯電し陰イオンになる。
1個の原子からできたイオンなので単原子イオンと言う。
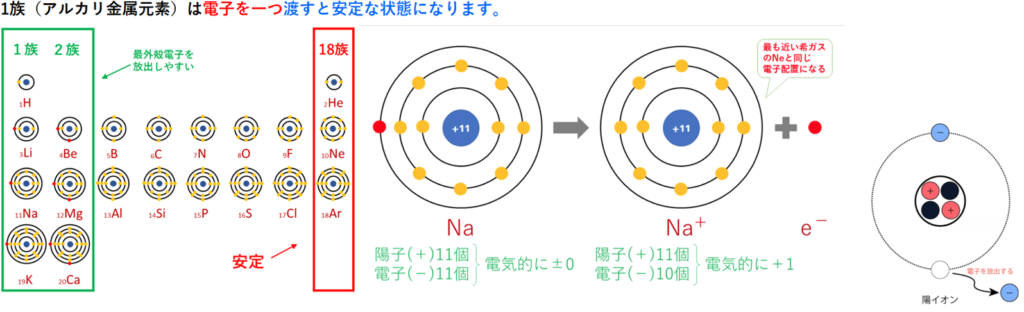
・陽イオン:第1族のNaや第2族のMg等は、最外殻電子が1個や2個存在する。
第18族の希ガスの電子配置(オクテット)は安定的な為、オクテットに電子を1つや2つ加えた第1族や2族は簡単に最外殻電子を1個または2個放出でき、
1価の陽イオン(Na⁺)や2価の陽イオン(Mg²⁺)等になる。
2価の陽イオン:Mg²⁺(マグネシウムイオン)の電子配置は
Mg→Mg²⁺+2e⁻
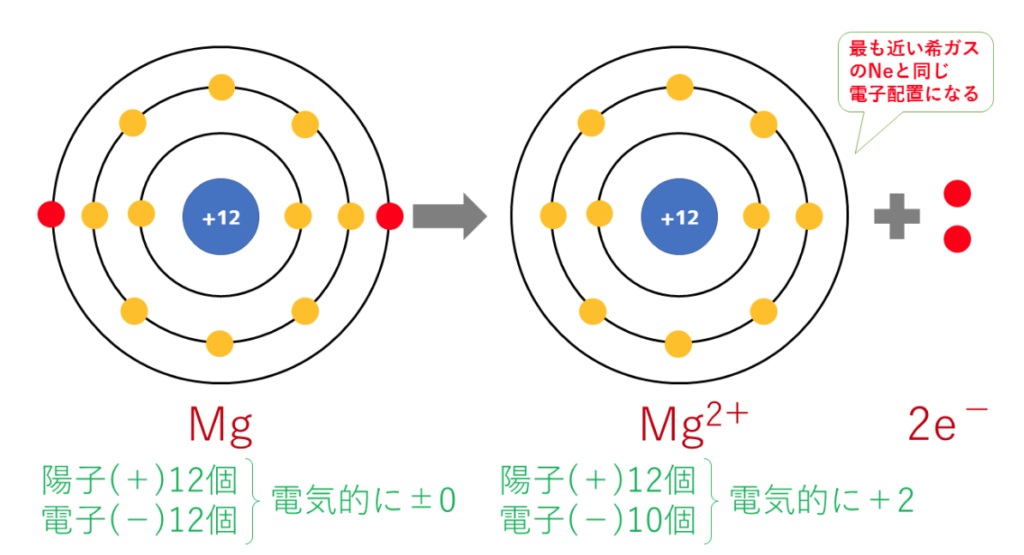
最終的に、Mg(原子番号12番)と原子番号が最も近い希ガスのNe(原子番号10番)と同じ電子配置となる。
陽子は12個で変わらないのに対し、電子は10個に減少したため、二つだけプラスが多くなり、Mg²⁺となる。
3価の陽イオン:Al³⁺(アルミニウムイオン)の電子配置は
Al→Al³⁺+3e⁻

最終的に、Al(原子番号13番:第13族)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となる。
陽子は13個で変わらないのに対し、電子は10個に減少したため、三つだけプラスが多くなり、Al³⁺となる。
・陰イオン:第16族のOや第17族のF等は、最外殻電子が6個や7個存在する。
第18族の希ガスの電子配置(オクテット)は安定的な為、第16族や17族等、18族の原子番号の最も近い希ガスの電子配置になろうする。
ちなみに、陰イオン(単原子イオン)の名称は、「~化物イオン」か「~酸イオン」となる。
1価の陰イオン(Cl⁻)や2価の陰イオン(O²⁻)等になる。
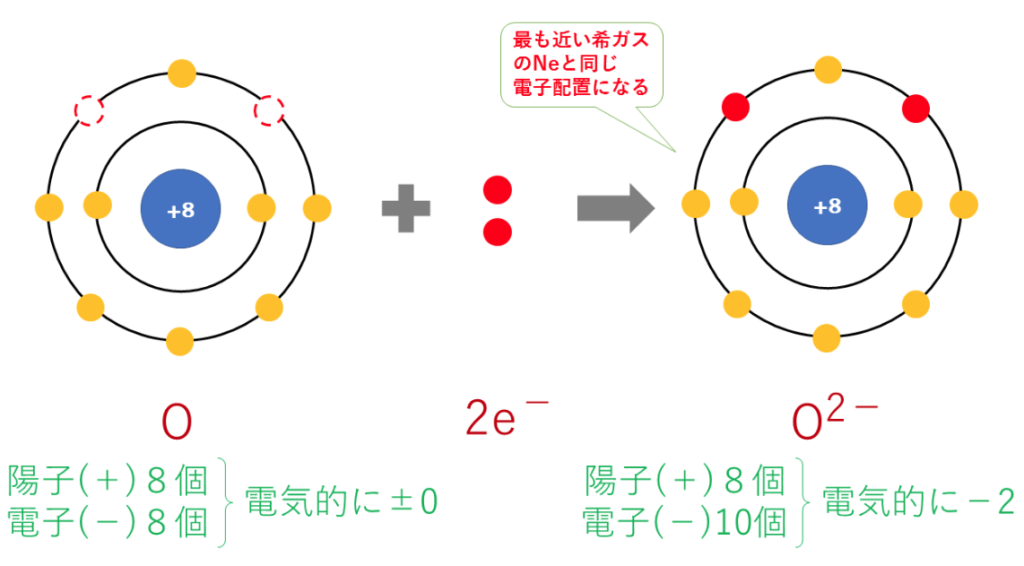
2価の陰イオン:O²⁻(酸化物イオン)の電子配置は
O+2e⁻→O²⁻
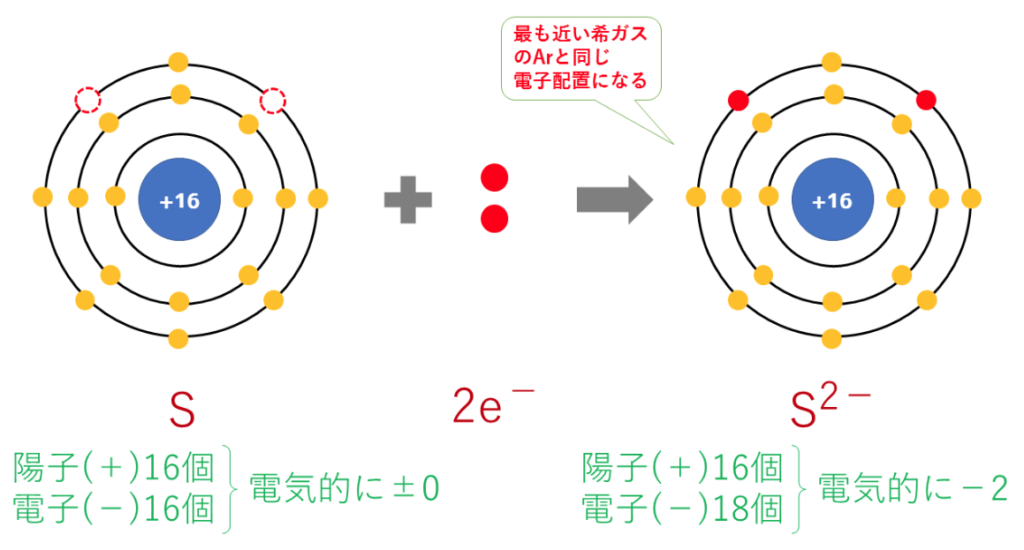
2価の陰イオン:S²⁻(硫化物イオン)の電子配置は
S+2e⁻→S²⁻
◆多原子イオン
多原子イオンとは複数の原子が結合し、更に電子の放出・受け取りが起きてできたイオンである。
・1価の陽イオン:NH₄⁺(アンモニアイオン)
⇒N原子1個とH原子4個が結合して、全体で+1。
・1価の陰イオン:OH⁻(水酸化物イオン)
⇒O原子1個とH原子1個が結合して、全体で-1。
・1価の陰イオン:NO₃⁻(硝酸イオン)
⇒N原子1個とO原子3個が結合して、全体で-1。
・2価の陰イオン:SO₄²⁻(硫酸イオン)
⇒S原子1個とO原子4個が結合して、全体で-2。
・2価の陰イオン:CO₃²⁻(炭酸イオン)
⇒C原子1個とO原子3個が結合して、全体で-2。
・3価の陰イオン:PO₄³⁻(炭酸イオン)
⇒P原子1個とO原子4個が結合して、全体で-3。

◆陽イオンと陰イオンの結合(組成式)
陽イオンと陰イオンは電気的に+と-なので、両者間には電気的な引力が生じる。
この引力を静電気力またはクーロン力という。
この為、陽イオンと陰イオンは結合する事が出来る。この結合をイオン結合といい、この結合によってできた物質をイオンからなる物質という。
電気の+、-はは1対1で引き合う。
◆組成式の書き方
①陽イオン→陰イオンの順に並べる
⇒Na⁺ Cl⁻
②陽・陰イオンの数の比を求める
Na⁺の価数が+1、Cl⁻の価数が−1なので、
⇒Na⁺ Cl⁻(1:1)
③上記②の比を元素記号の右下に書く(イオンの個数の比「1」は省略)
⇒NaCl(塩化ナトリウム)
・酸化アルミニウム:Al₂O₃
①陽イオン→陰イオンの順に並べる
Al³⁺ O²⁻
②陽・陰イオンの数の比を求める
Al³⁺の価数が+3、O²⁻の価数が−2なので、
⇒Al³⁺ O²⁻(2:3)
⇒Al³が2個、O²⁻が3個だとプラスマイナスがゼロとなる。
③上記②の比を元素記号の右下に書く(イオンの個数の比「1」は省略)
⇒Al₂O₃(酸化アルミニウム)
・硫酸ナトリウム:Na₂SO₄
①陽イオン→陰イオンの順に並べる
Na⁺ SO₄²⁻
②陽・陰イオンの数の比を求める
Na⁺の価数が+1、SO₄²⁻の価数が−2なので、
⇒Na⁺ SO₄²⁻(2:1)
⇒Na⁺が2個、SO₄²⁻が1個だとプラスマイナスがゼロとなる。
③上記②の比を元素記号の右下に書く(イオンの個数の比「1」は省略)
⇒Na₂SO₄(硫酸ナトリウム)
・NH₄⁺とSO₄²⁻の多原子同士の場合:(NH₄)₂SO₄(硫酸アンモニウム)
①陽イオン→陰イオンの順に並べる
NH₄⁺ SO₄²⁻
②陽・陰イオンの数の比を求める
NH₄⁺の価数が+1、SO₄²⁻の価数が−2なので、
⇒NH₄⁺ SO₄²⁻(2:1)
⇒NH₄⁺が2個、SO₄²⁻が1個だとプラスマイナスがゼロとなる。
③上記②の比を元素記号の右下に書く(イオンの個数の比「1」は省略)
(NH₄)₂SO₄(硫酸アンモニウム)
注:多原子同士場合で一方が複数の場合には、例(NH₄)₂のように( )の右下に数値を記入する。
2.分子(共有結合)
・1種類の原子から出来ている分子と2種類以上の原子から出来ている分子がある。
水素(H)や酸素(O)などの気体は、いくつかの原子が結びついて一つのまとまりになっている粒子で、その粒子は分子と呼ばれ、固体や液体の物資でも分子が確認されている。
結びつく原子の数や出来る形は、分子の種類によって決まっており、物質の性質を表す。
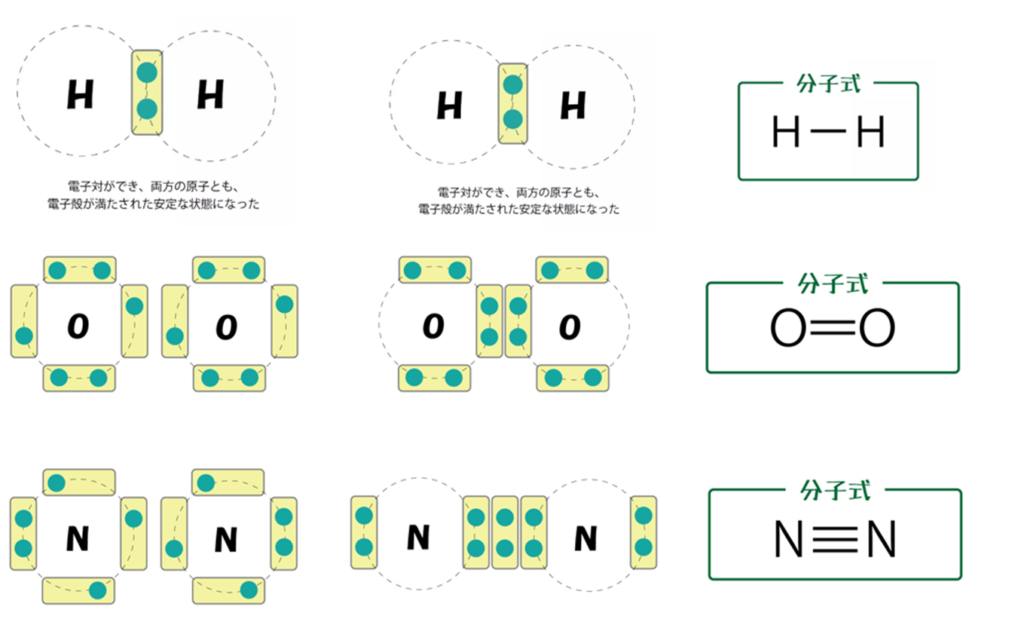
<1種類の原子が2個結びついている分子>
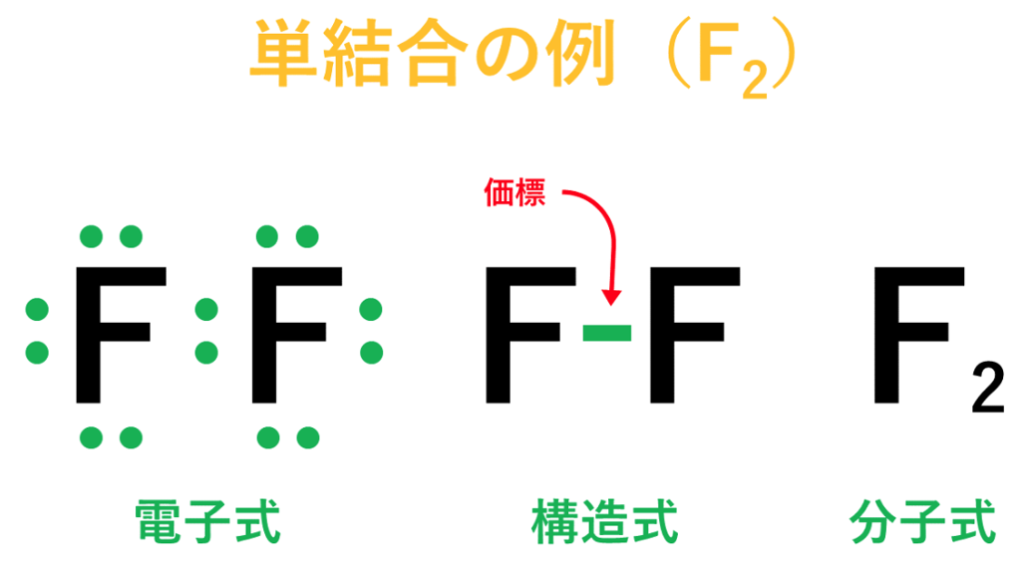
・フッ素(F)の場合は、フッ素原子(F)が2個結びついてフッ素分子(F₂)が出来ている。
・酸素(O)の場合は、酸素原子(O)が2個結びついて酸素分子(O₂)が出来ている。
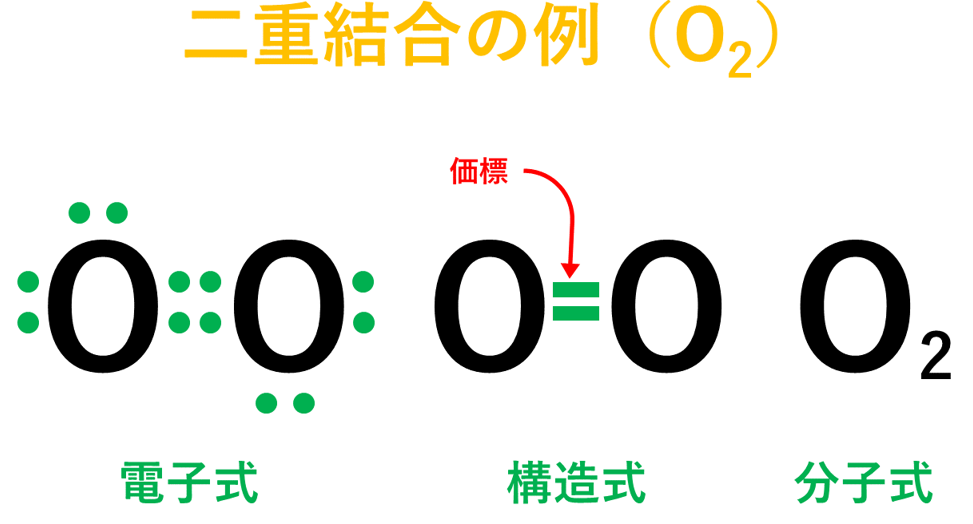
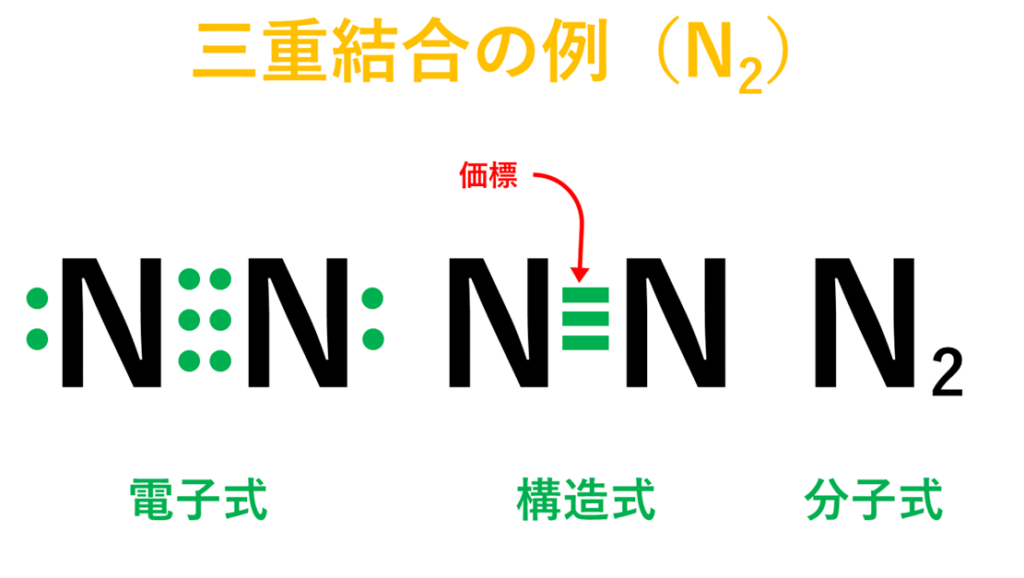
・窒素(N)の場合は、窒素原子(N)が2個結びついて窒素分子(N₂)が出来ている。
<2種類以上の原子が結びついている分子>
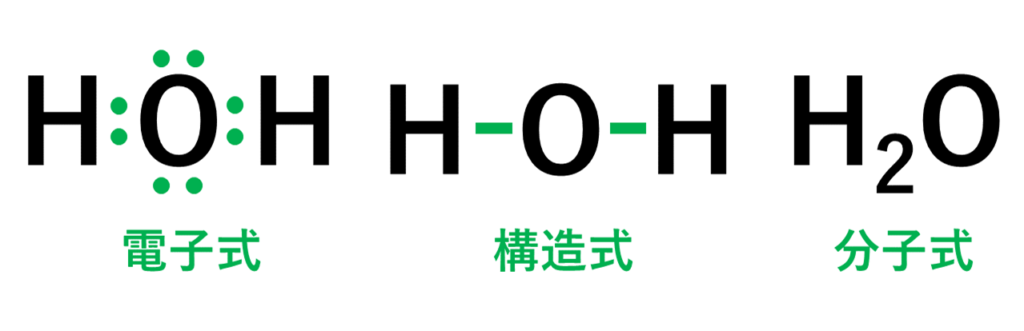
・水(H₂O)の場合は、水素原子(H)2個と酸素原子(O)1個が結びついて、水の分子ができている。
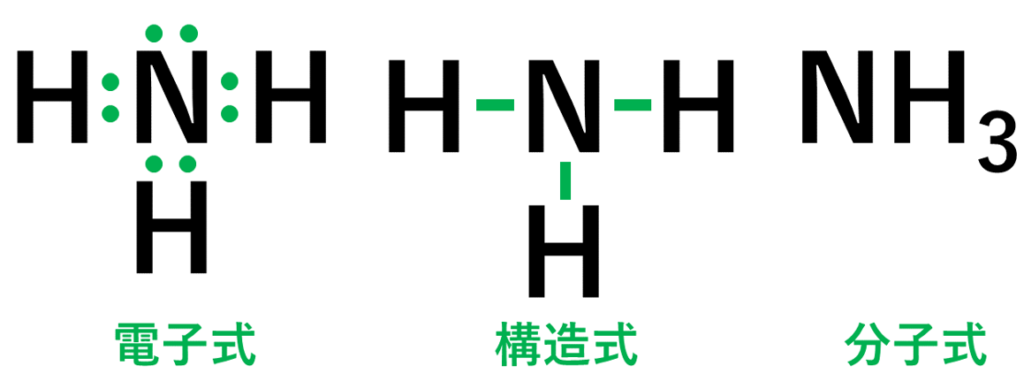
・アンモニア(NH₃)の場合は、窒素原子(N)1個と水素原子(H)3個が結びついて、アンモニアの分子ができている。
・二酸化炭素(CO₂)の場合は、炭素原子(C)1個と酸素原子(O)2個が結びついて、二酸化炭素の分子ができている。

3.単体と化合物
水素(H)や酸素(O)、鉄(Fe)、銅(Cu)等は1種類の原子から出来ている。
このうち、水素(H)や酸素(O)等は、1種類の原子が2個結びついた分子の集まりである。
尚、水(H₂O)や二酸化炭素(CO₂)などは、複数の原子が結びついた分子が集まった物質である。
鉄(Fe)、銅(Cu)は1種類の原子が沢山結びついて出来ている物資で、分子というまとまりを持たない。
分子というまとまりを持つか持たないかは物質によって決まる。
・単体:原子1種類で出来ている物資。
⇒『気体』と『金属』がある。
『気体』:単体の気体は必ず2個の原子が結びついて1個の分子になって存在している。
【化学式】水素:H₂、酸素:O₂、窒素:N₂、塩素:Cl₂
『金属』:原子の記号をそのまま書けばよいルール
【化学式】鉄:Fe、銅:Cu、マグネシウム:Mg、銀:Ag
尚、炭素(C)と硫黄(S)は『金属』ではないが、原子の記号をそのまま書いて表すルールになっている
【化学式】炭素:Cと硫黄:S
・化合物:2種類以上の原子で出来ている物質。
⇒気体+気体』という化合物と『金属+気体』という化合物がある。
『気体+気体』という化合物
・H₂O:水、CO₂:二酸化炭素、NH₃:アンモニア、等
『金属+気体』という化合物
塩化ナトリウム:NaCl(ナトリウム+塩素)、酸化マグネシウム:MgO(マグネシウム+酸素)、硫化鉄:FeS(鉄+硫黄)、塩化銅:CuCl₂(銅+塩素)
・上記の化合物の名前のルール
⇒気体(塩素や酸素等『〇素』を『〇化』と言い換える
⇒読む順は『後ろを先』に読む
例:塩化ナトリウム:NaCl(ナトリウム+塩素)
塩化ナトリウム→ナトリウム+塩化→ナトリウム+塩素→NaCl
■■酸化還元反応とは?
酸化還元反応は酸化と還元に分けられる。
酸化と還元が同時に起こる反応が酸化還元反応である。
・酸化:ある物質が酸素と化合して、水素を奪われる事、又は電子を失う事。
・還元:ある物資が酸素を奪われて水素と化合する事、又は電子を受け取る事。


①電子のやり取りで考える概念。
★電子のやり取りが分かり易くなる『酸化数』という考え方
色んな化学反応において、
原子やイオンの電子の授受を明確にするために、『酸化数』という数値を用いる。
◆酸化数
化合物やイオンを構成している原子が、電気的に中性な原子と比べて、
・電子を何個(n個)失った(どれだけ酸化された)状態にあるか
⇒酸化数は+n個
・電子を何個(n個)受け取ったか(どれだけ還元された)状態にあるか
⇒酸化数は-n個
を示す数値である。


e⁻(電子)はマイナスの電荷を持った粒子であるから、
・e⁻(電子)を失う→電気的に中性(陽子数=電子数)な原子は正(+:陽子数>電子数)の電荷になる。
・e⁻(電子)を受け取る→電気的に中性陽子数=電子数)な原子は負(-:陽子数<電子数)の電荷になる。
尚、原子は最外殻電子数が8個が安定な構造である。
例えば、価電子数が1個の原子なら
電子を受け取るにしても7個までしか受け取る事はできないので、
酸化数は『−7』が最小になる。
⇒酸化数の大きさ:最小値は『価電子数-8』
価電子数が7個の原子なら
電子を失う(放出)にしても7個までしか失う(放出)事はできないので、
酸化数は『+7』が最大になる。
⇒酸化数の大きさ:最大値は『価電子数』
◆電子のやり取り
・イオン結合は分かり易い。
⇒電子を失えば陽イオンになり、電子を受け取れば陰イオンになる。
イオン結合は陽イオンと陰イオンがクーロン力(静電気力)によってお互いに引き合って出来る結合だから、原子間での電子の受け渡しがはっきりしている。

・共有結合では
電子を原子間で共有(不対電子を電子対で共有)しているので、
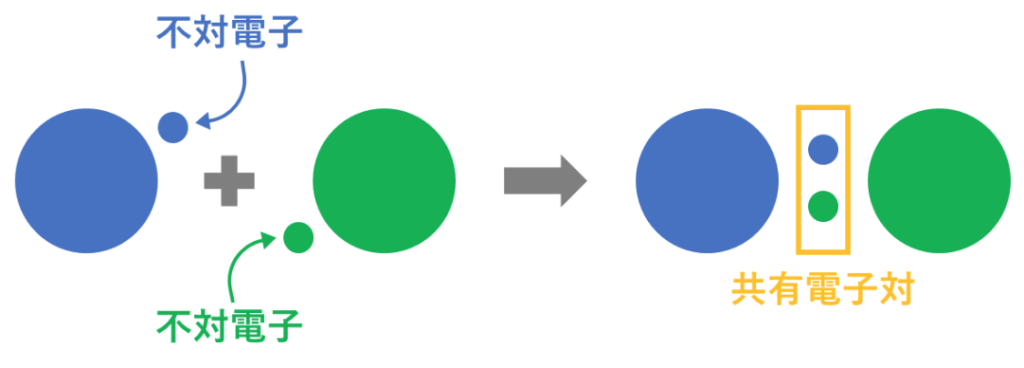
受け渡しが曖昧である。
分子をつくている原子にも
共有電子対を引きつける強さに違いがある(電子陰性度)。
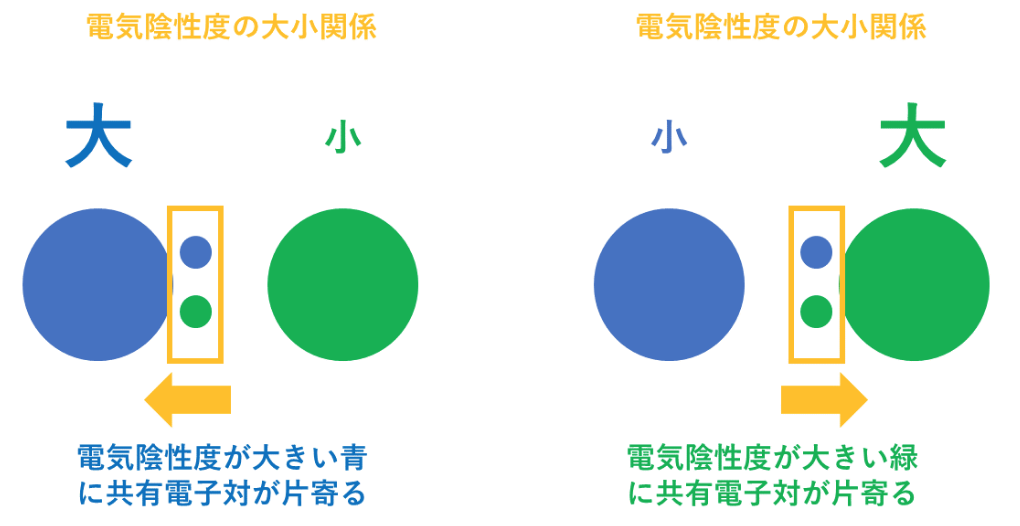
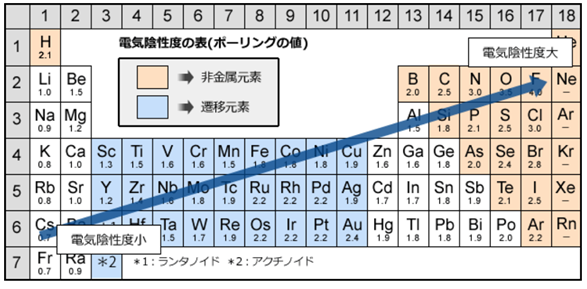
<電気陰性度>
電気陰性度は、分子中の原子がe⁻(電子)を引き付ける強さの事を指す。
言い換えれば、プラスの電気(原子中の陽子)が、マイナスの電気(e⁻(電子))を引き付ける強さと同じである。
従って、同じ周期の元素では(周期表の横行)、右側に行くほど陽子の数が増えるのでプラスの力が強まり、電気陰性度は大きくなる。

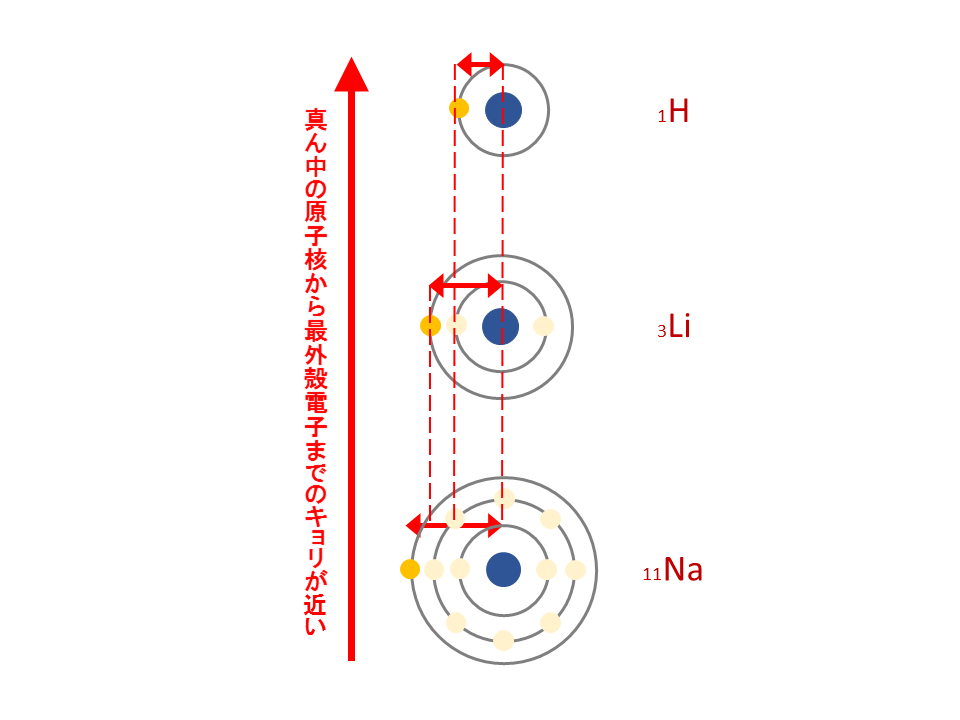
同じ族では(周期表の縦列)、下に行くほど電子の位置が原子から遠くなり、
遠くの電子に対してかかるプラスの力は弱くなるので、電気陰性度は小さくなる。
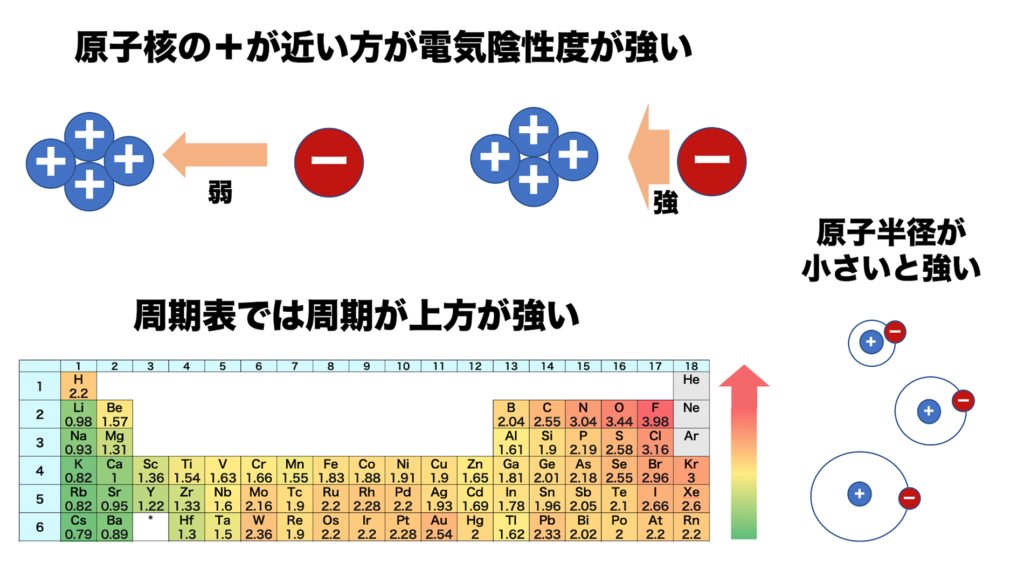

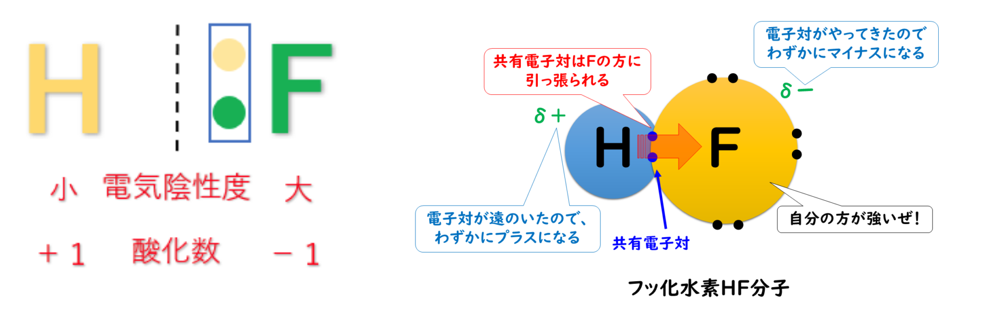
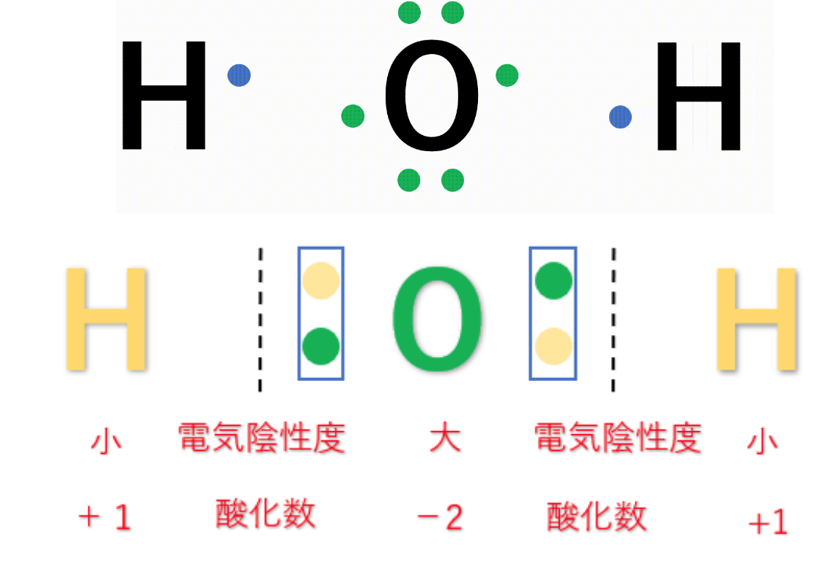
例えば、第1族の水素原子(H:2.2)と第17族のフッ素原子(F:4.0)では、電気陰性度の大きさはH<Fなので、共有電子対はFの方に引き付けられる。
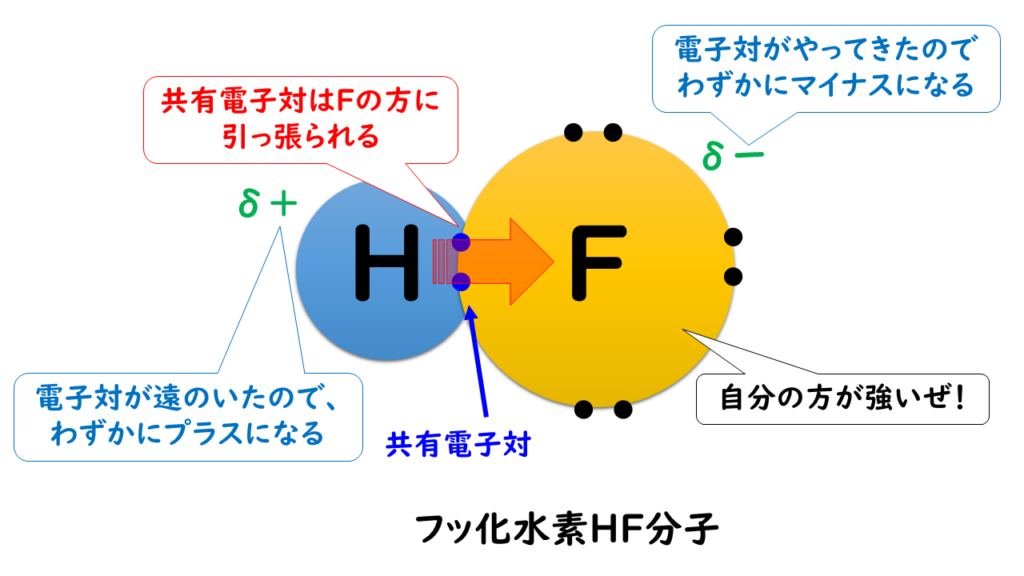

この時、H(水素)はもともと持っていた1つのe⁻(電子)さえも、F(フッ素)に引っ張られてしまうので、酸化数は『+1』になる。
F(フッ素)はH(水素)の持っているe⁻(電子)を1個、自分の方に引きつけているので、酸化数は『-1』になる。
共有結合で出来ている物質は、
電子式を書いて、電気陰性度の大きさを考えて『酸化数』を決めなければならないので、少し分かりづらい。

◆酸化数を決めるルール
①単体中の原子の酸化数は『0』
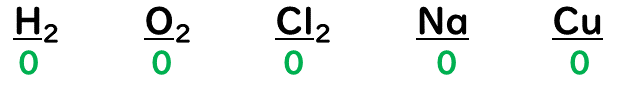
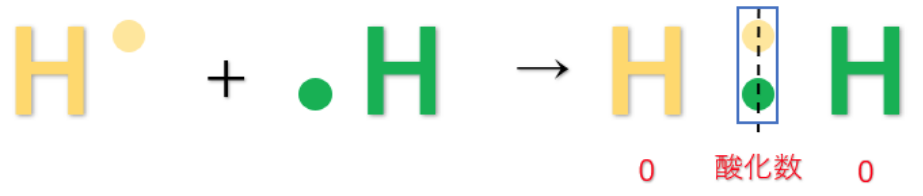
⇒単体は、2つの原子の電気陰性度に差が無いので共有電子対は原子の真ん中に存在する。その為、e⁻(電子)を失う事も得る事もないので酸化数は『0』になる。
②単原子イオン中の原子の酸化数は、イオンの価数に等しい

⇒単原子のイオンの酸化数はそのイオンの電荷と等しくなる
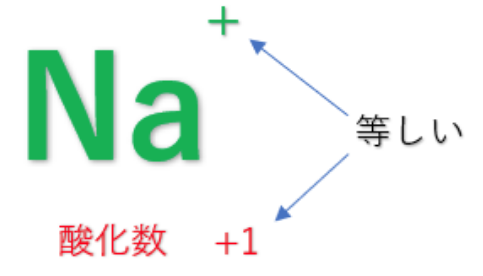
③化合物中の水素原子(H)の酸化数は『+1』、酸素原子(O)の酸化数は『-2』とする。
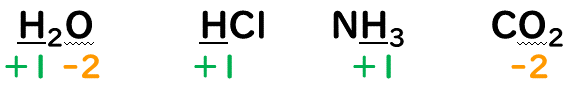
・H(水素原子)の酸化数
⇒H(水素原子)は、他の非金属元素に比べると電気陰性度が小さくなるので
共有電子対は結合している原子に引き付けられる。
その為、酸化数は+1になる。

⇒但し、金属元素と結合するときは金属元素より電気陰性度が大きくなる為
共有電子対がH(水素原子)に引き付けられる。
その為、酸化数は-1になる。

・O(酸素原子)の酸化数
⇒O(酸素原子)は、電気陰性度が大きく、
2組の共有電子対を引き付ける。
酸化数は-2になる。
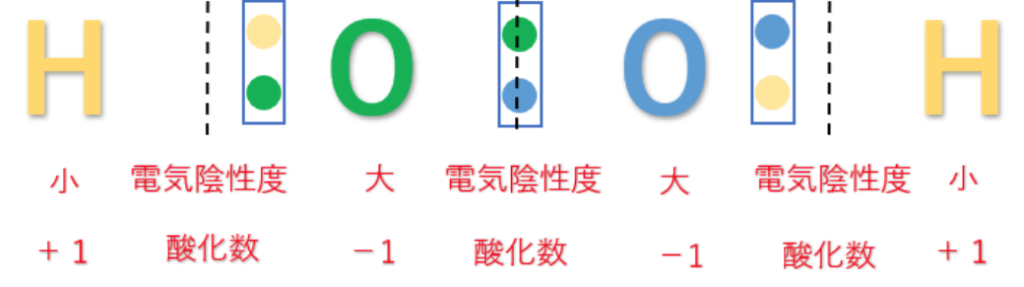
但し、H₂O₂(過酸化水素)のような過酸化物(-O-O-構造)を持っときは、
片方の共有電子対しか引き付けないので
酸化数は-1になる。
④化合物中の各原子の酸化数の総和は『0』
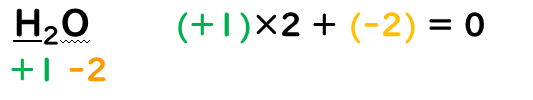
化合物は異なる原子同士が結合してできているので、原子間に電気陰性度に差が生じる。
例としてHF(フッ化水素)について
電気陰性度の大きさはH<Fなので、共有電子対はFの方に引き付けられ、F(フッ素)原子はe⁻(電子)を得ていると考えられる。
しかし、化合物全体で見た時には電子の総数に変化はないため化合物の酸化数は『0』になる。
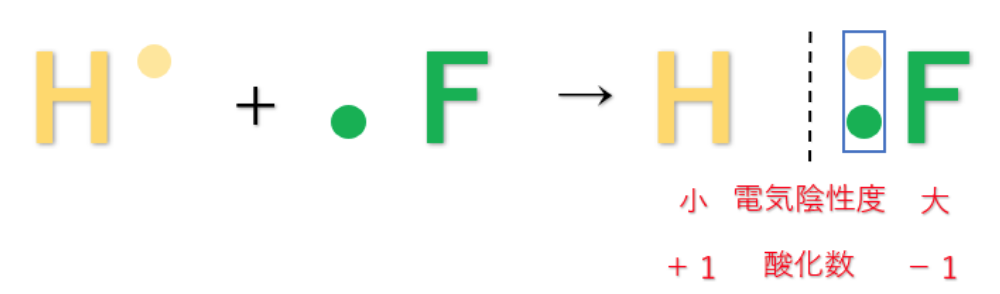

⑤多原子イオン中の各原子の酸化数の総和は、イオンの価数に等しい
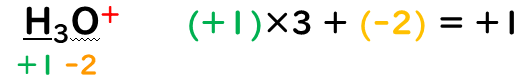
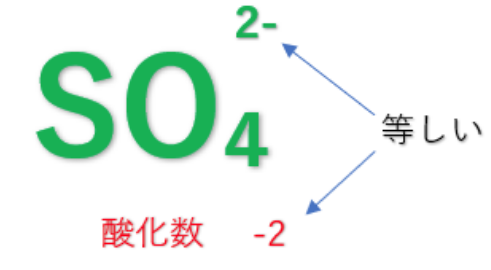
SO₄²⁻(S:+6、O:-2)→(+6+(-2)×4)=-2
⑥第17族ハロゲンの酸化数
ハロゲンは、電気陰性度が大きいため、
共有電子対を引き付ける。
酸化数は-1になる。
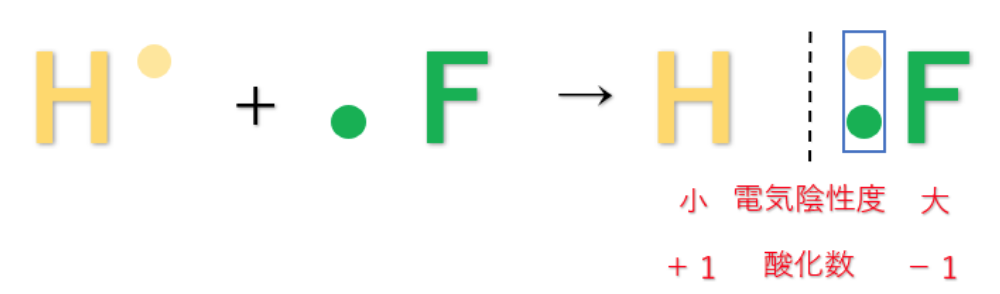
⑦第1族アルカリ金属(H以外)・第2族アルカリ土類金属の酸化数
アルカリ金属や2族元素は電気陰性度が小さいため、
共有電子対は結合している原子に引き付けられる。
酸化数は+1、+2になる。

◆酸化数のルールのまとめ
・一つ目のルール
①単体の場合→酸化数は『0』。
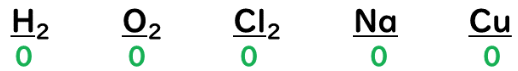
②化合物の場合→化合物全体の酸化数は『0』。

③イオンの場合→イオン全体の酸化数は『電荷に等しい』。

・二つ目のルール
①第1族アルカリ金属(H以外)の酸化数は+1、第2族アルカリ土類金属の酸化数は+2、第17族のハロゲンの酸化数は相手側が金属の場合-1。
②H(水素原子)の酸化数は相手側が非金属の場合+1。
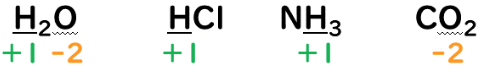
③O(酸素原子)の酸化数は-2。
④S(硫黄原子)の酸化数は-2。
<酸化数を求める計算事例>
1)CaCl₂
・Caはアルカリ土類金属:+2
・Clはハロゲン金属で相手側が金属より:-1
Ca=+2、Cl₂=(-1)×2=-2
・1つ目のルール:②化合物の場合→化合物全体の酸化数は『0』。
CaCl₂=+2+(-2)=0
3)H₂SO₄
・Hは相手側が非金属:+1
・OはH₂O₂(過酸化水素)のような過酸化物(-O-O-構造)ではない:-2
H₂=+1×2=+2、O₄=(-2)×4=-8
・1つ目のルール:②化合物の場合→化合物全体の酸化数は『0』。
・Sはルールにないのでxとする
+2+x+(-8)=0
x=+6。Sの酸化数=+6

3)MnO₄⁻
・MnO₄⁻は多原子イオン
・Mnはルールにないのでxとする
・OはH₂O₂(過酸化水素)のような過酸化物(-O-O-構造)ではない:-2
・1つ目のルール③イオンの場合→イオン全体の酸化数は『電荷に等しい』。
x+(-2)×4=-1
x=7。Mnの酸化数=+7
注:ルールを使うと簡単に酸化数が求まるが、
簡単の構造の分子やイオンしか用いる事ができない。
例えば、CH₃COOHのような複雑な構造(含まれてるCの酸化数が異なる)を持つ物質には使う事が出来ない。
電子式を書くしかない。