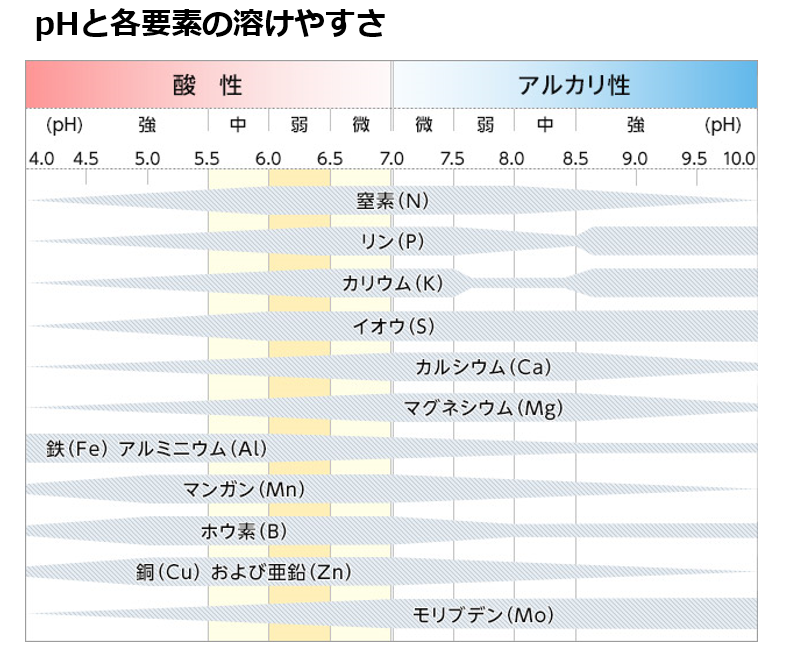
■■土の粒子と吸着力
土壌は作物に必要な養分を保持しながら適切に供給する機能を持っている。
土壌に施用された肥料成分は、土壌粒子にくついたり離れたりしながら、『水に溶けて』土の中を移動する。
その移動しやすは、土壌と肥料成分毎に異なっている。
◆土壌粒子はマイナス電荷を持つ
土壌診断には乾燥した土を2mmのふるいを通して分析試料としている。
2mm以上は石ころで土壌ではない。
2mm~0.02mm程度の砂粒は、通気性や排水性を高める働きはあるが、『養分』をくっつける事はできない。
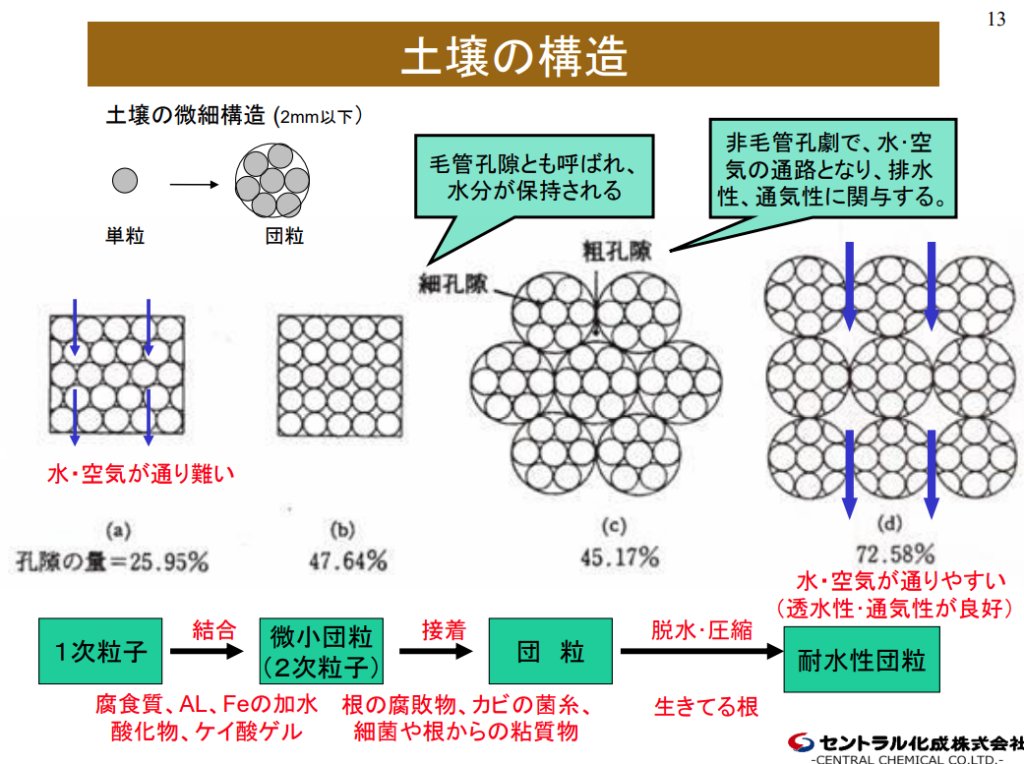
0.001mm以下の『粘土(粘土鉱物)』になると表面にマイナスの荷電を帯びるようになる。
マイナスの荷電を帯びていることは、農業ではどのような意味を持っか?

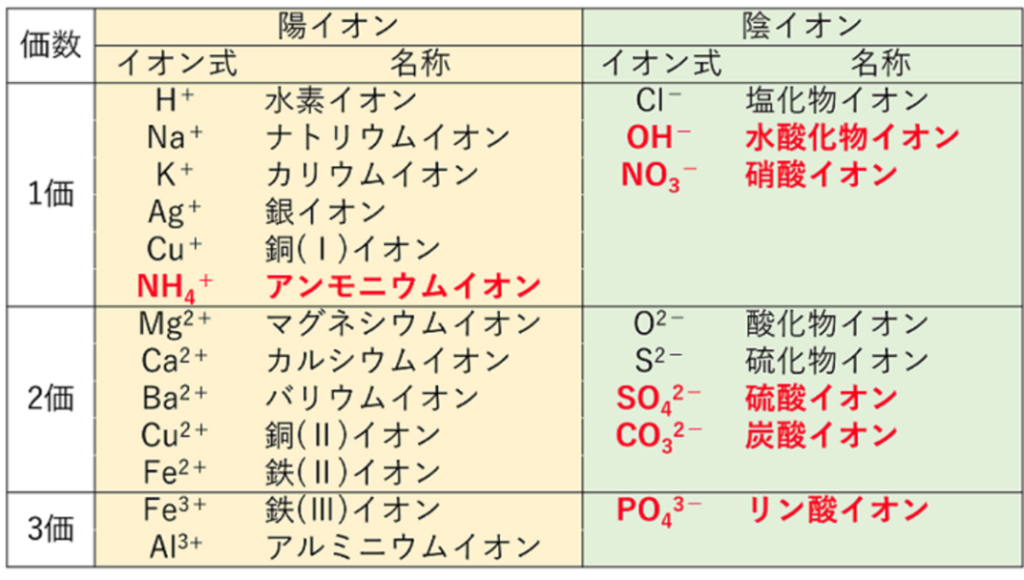
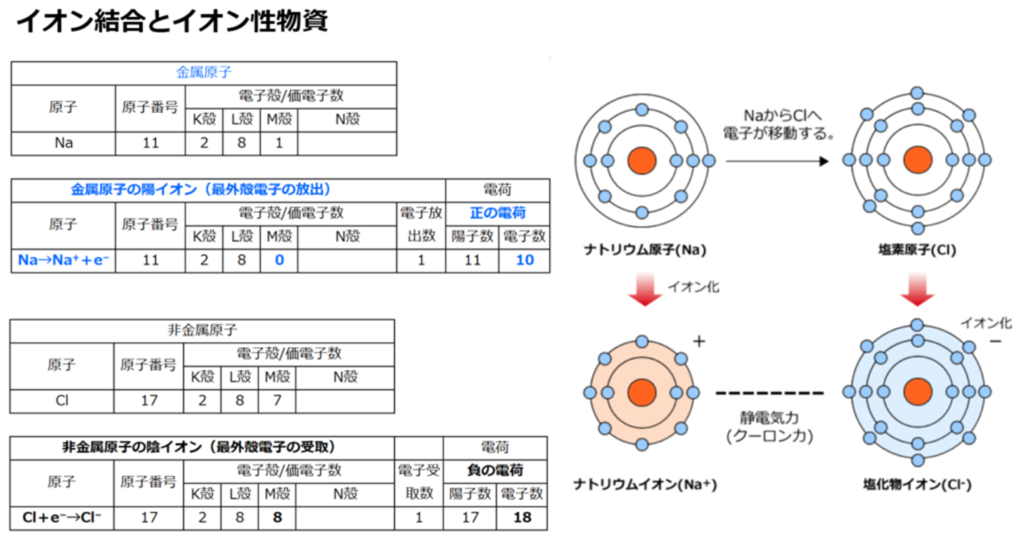
肥料として土に入れる無機養分であるカリウム(K)、カルシュウム(Ca)、マグネシウム(Mg)等が、
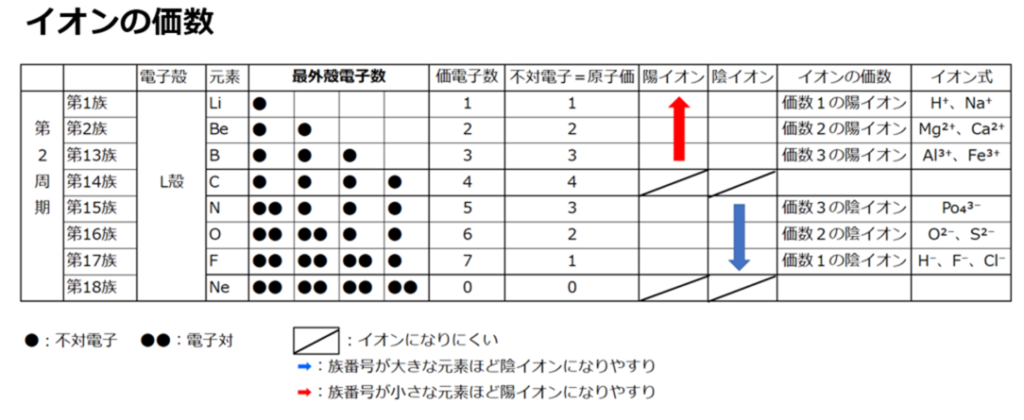
『水に溶ける』とプラスの荷電を持った陽イオンになる。
⇒カリウムイオン(K⁺)、カルシュウムイオン(Ca²⁺)、マグネシウムイオン(Mg²⁺)
尚、窒素(N)の多くはアンモニウムイオン(NH₄⁺)として、やはり陽イオンで存在する。
マイナスの荷電を持った土壌粒子(土壌コロイド)は、これらのプラスの荷電を持った養分をくっつけて保持できるようになる。
つまり土壌コロイド(負荷電)が肥料成分(陽イオン)を引き付ける(吸着する)。
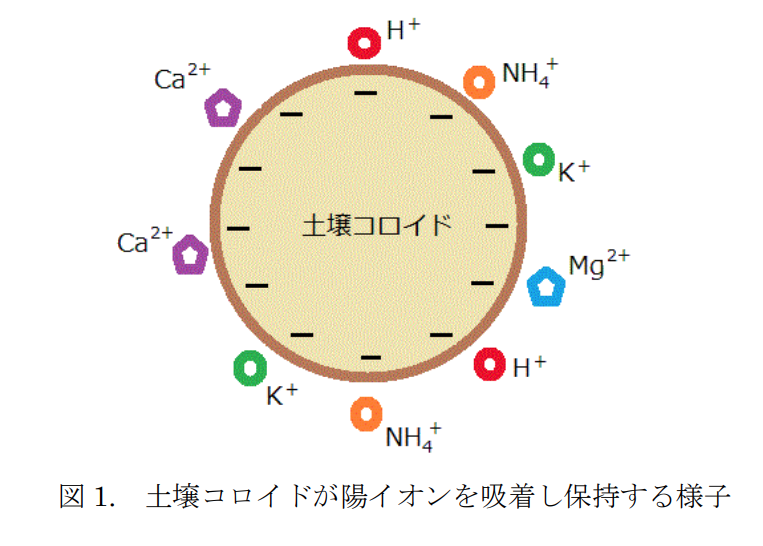
くっつき易さは養分の種類によって異なっており、1価の陽イオンK⁺よりも2価の陽イオンCa²⁺やMg²⁺の方が強く保持される。
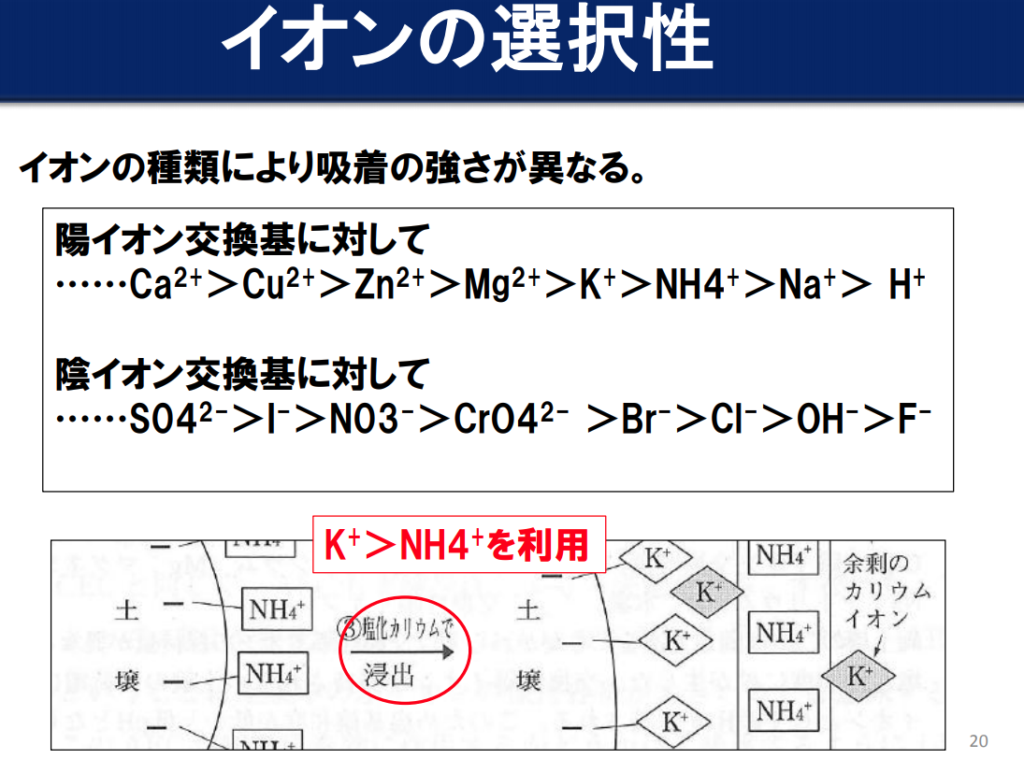
新しい養分が入ってきた場合は、
強く保持される方が弱い方を追い出して入れ替わる。
尚、土壌酸性化の原因となる水素イオン(H⁺)は、土壌にかなりくっつきやすいので、カルシュウムイオン(Ca²⁺)等の養分を追い出して徐々に酸性化が進行する事になる。
これら農作物にとって有用な陽イオンを持った肥料成分を『塩基』といい、負荷電の土壌コロイドに吸着される現象を『塩基の吸着』という。
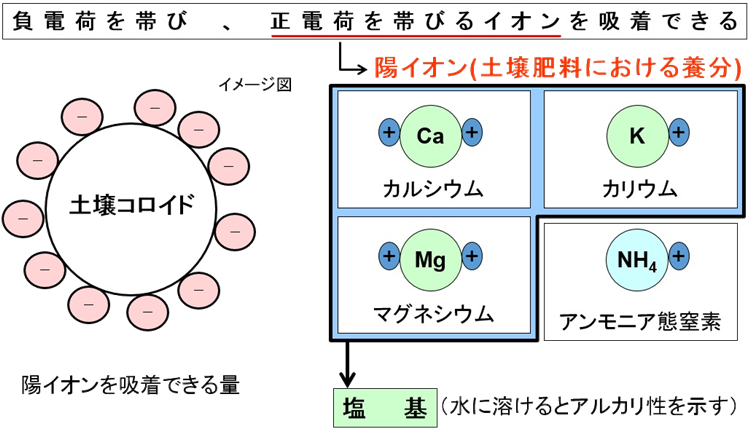
◆農作物に有用な陽イオンを捕まえる土壌コロイド
土壌に農作物の栄養となりえる陽イオンが増えたとしても、それらが農作物に吸収される前に降雨で流されては意味がない。
土の中ではどのようにして陽イオンが保持されているのだろうか?
その役割を果たしているのが『土壌コロイド』である。
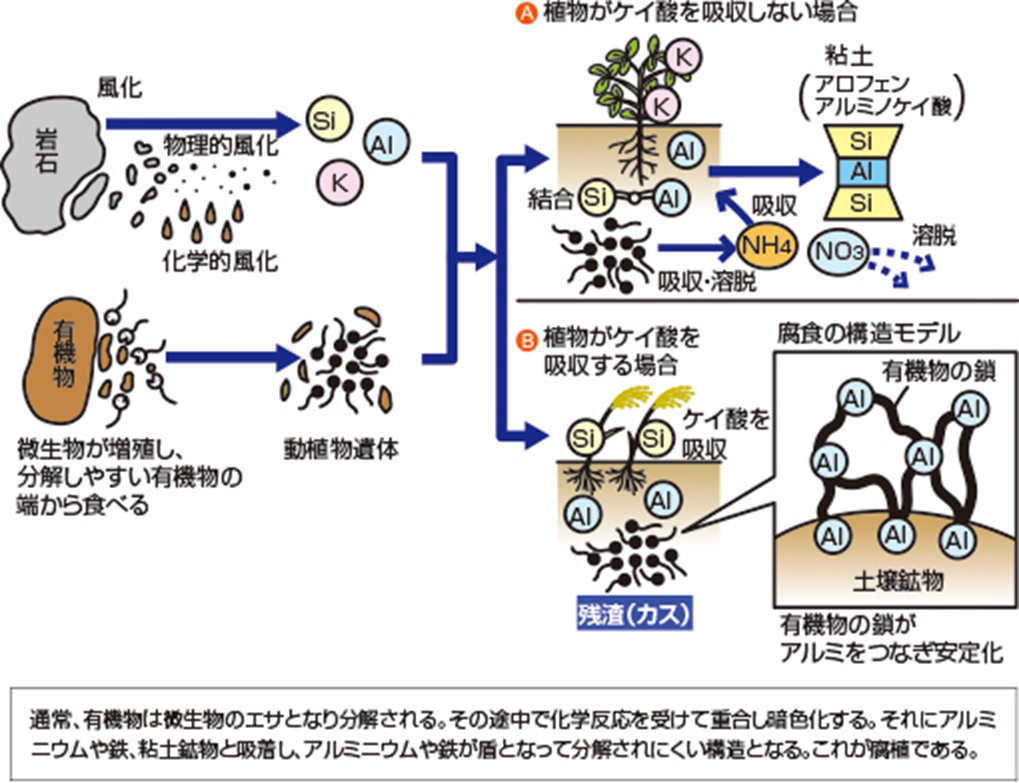
土壌中には、粘土鉱物と腐植が結びついてできた土壌コロイドという粒子が存在する。
負電荷の粘土鉱物が正電荷の無機栄養を引き付け(吸着する)、
腐植も負電荷で、無機栄養を引き付ける(吸着する)。
粘土鉱物や腐植に、無機栄養が一時的に吸着・保持されるメカニズムが働く。
このメカニズムのおかげで降雨による無機栄養の流出が抑えられ、
農作物が必要とする以上の量を施肥しても土壌の中で蓄えられ、
後でその蓄えの中から無機栄養を少しずつ根から吸収できるのである。
尚、肥沃な土というのは色が黒みがかかっている事が多い。
これは腐食が含まれいると見る事ができる。
その腐植自体が分解して無機栄養を出す。
◆土壌コロイドの負電荷発生メカニズム
2つのメカニズムがある。
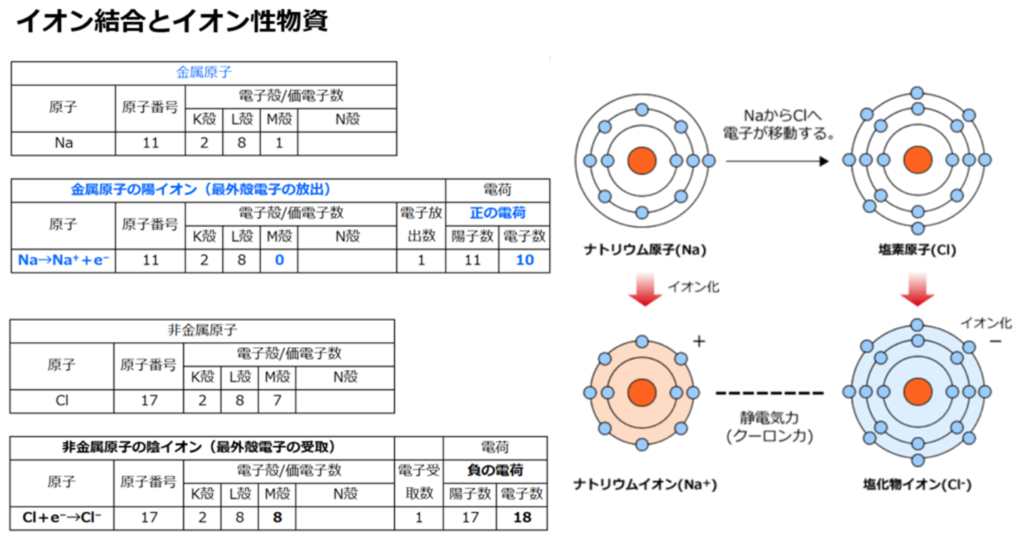
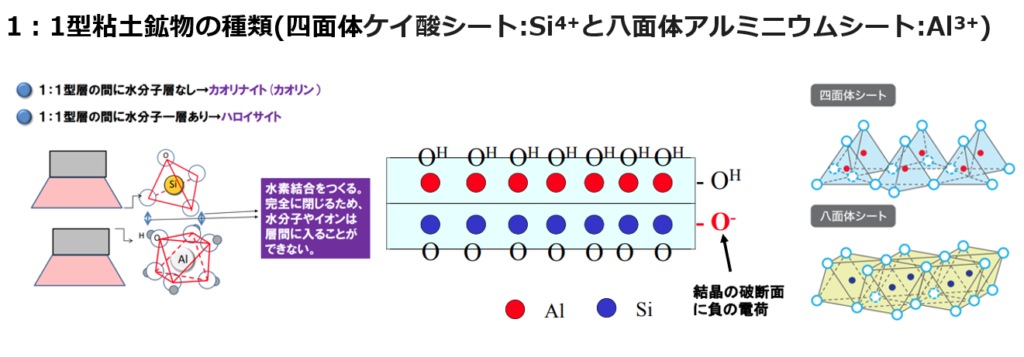
①層状ケイ酸塩鉱物における同形置換
粘土鉱物はアルミニウムシート(Al³⁺)とケイ酸シート(Si⁴⁺)で出来ており、電荷はプラス・マイナス0で均衡を保っている。
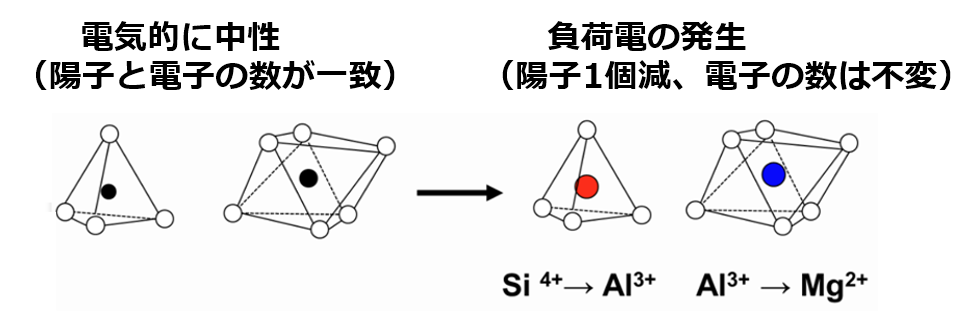
しかし、粘土の結晶が生成される途中で
アルミニウムシート(Al³⁺)の一部がマグネシウム(Mg²⁺)に置き換わる、あるいはケイ酸シート(Si⁴⁺)の一部がアルミニウムシート(Al³⁺)に置き換わると、
陽イオン(⁺)が不足する事により、粘土全体の電荷が陰イオン(⁻)になる。
この現象は同形置換と呼ぶ。
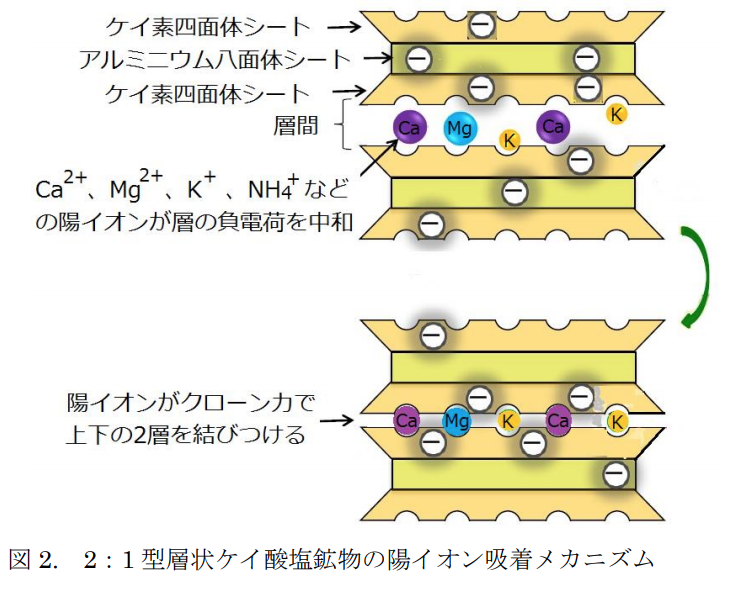
この負電荷の存在は2:1層を次の2:1層へ結び付ける重要な役目を持つ。
即ち、2:1型層状ケイ酸塩鉱物はその負電荷分だけの陽イオンを吸着して、
層間陽イオンとして層間に入り、
クーロンの力で上下の層を結び付ける。

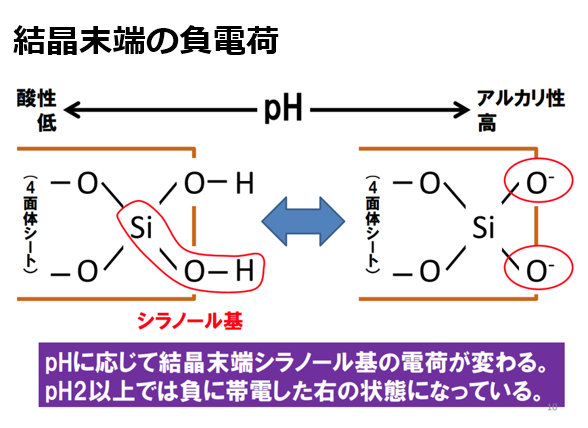
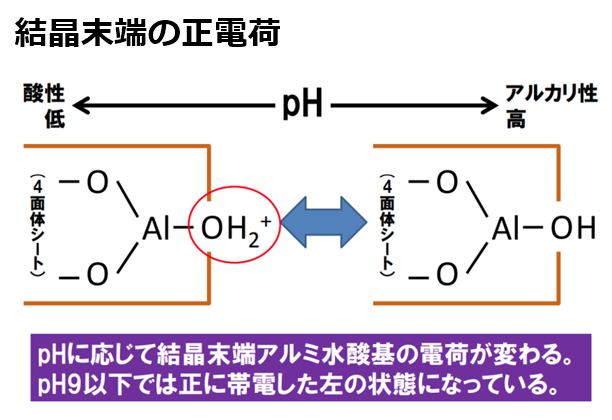
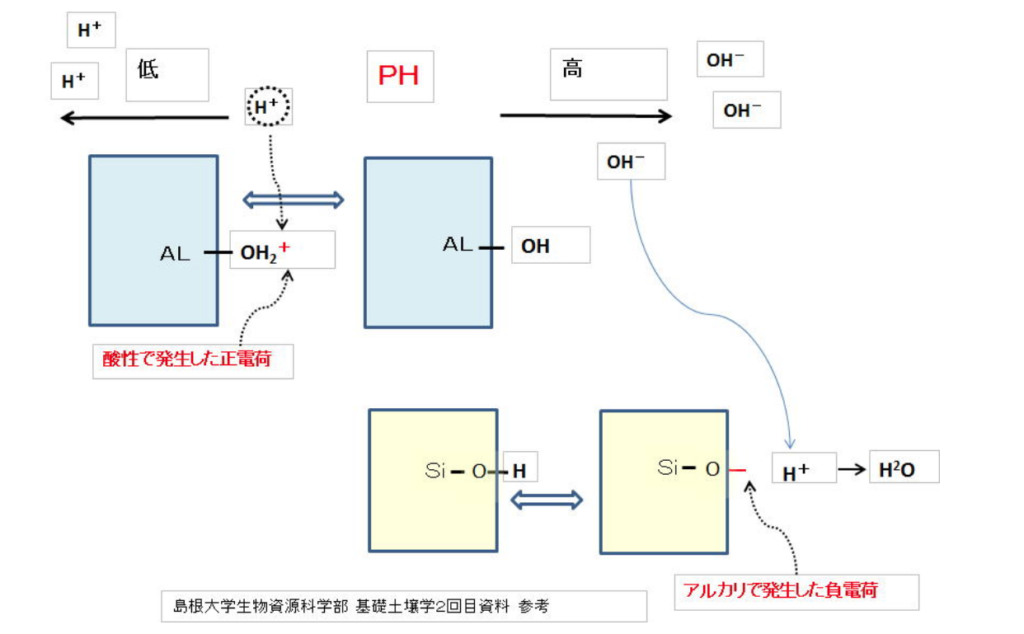
②pH依存荷電(変異荷電)と呼ばれ、結晶構造の『末端』で生じる。
アルミニウムシート(Al³⁺)やケイ酸シート(Si⁴⁺)は、鉱物端末に水酸基(OH)を有しており、pHの上下に応じて、水素イオン(H⁺)の出入りが生じる。
水素イオン(H⁺)はプラスに帯電しているので、pH上昇時(アルカリ条件)では水素イオン(H⁺)の放出により、粘土鉱物(ケイ酸シート(Si⁴⁺))はマイナスに帯電する。
-SiOH → -SiO⁻ + H⁺
pH下降時(酸性条件)では水素イオン(H⁺)が引き付けられ、粘土鉱物(アルミニウムシート(Al³⁺))はプラスに帯電する。
-AlOH + H⁺ → -AlOH₂⁺
◆養分吸収能力の指標:CEC(陽イオン交換容量)
陽イオンを保持する能力の大きさを数値で表したものがCEC(陽イオン交換容量)である。
乾土100g当り陽イオンのミリグラム当量meqで表し(1meq=原子量(mg)/荷電数)、
数値が小さいほど肥料保持力が低く、
逆に数値が高いほど肥料を土壌にためておく力が強い事を示す。
日本の土壌ではCEC(陽イオン交換容量)は比較的低く、数~40meq程度である。
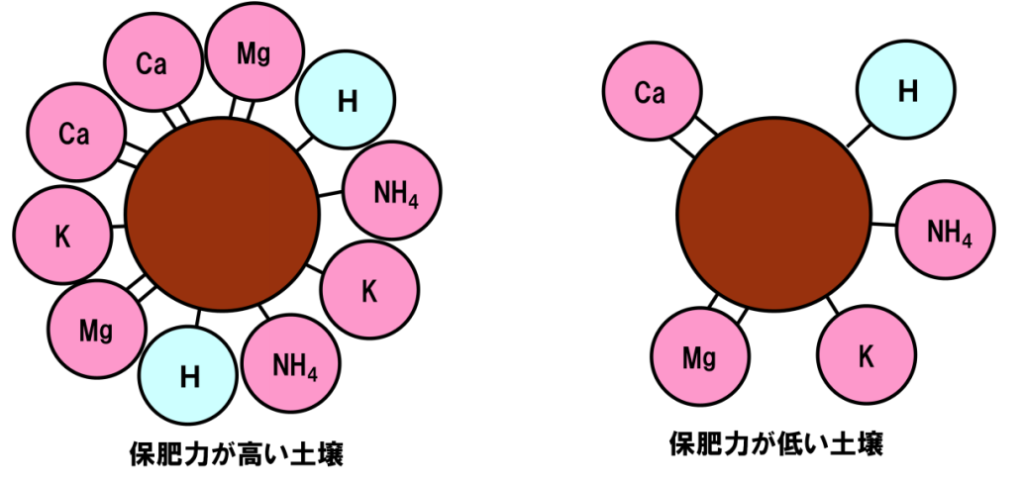
イメージとしては円卓と椅子の関係で円卓を土壌コロイド、椅子を陽イオンで比喩し、
保持力の強弱を
・椅子の数の多寡と
・陽イオンの椅子取りの仕方
①1価の陽イオンK⁺よりも2価の陽イオンCa²⁺やMg²⁺の方が強く保持される。
②塩基の空席には水素イオンが着席する鉄則
③作物は根から養分である陽イオンを吸収する
で理解する。

土壌改良をするにあたって、土壌固有のCEC(陽イオン交換容量)は必要な数値である。
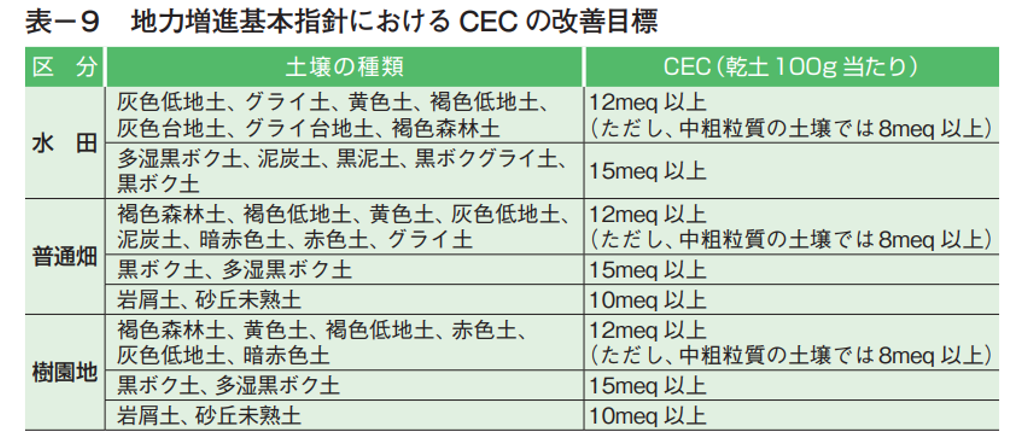
CEC(陽イオン交換容量)は土壌に含まれる粘土鉱物の種類・量に支配されるため、その改良は容易ではない。
しかし、堆肥などの有機物、腐植酸質資材やゼオライト、ペントナイトといった土壌改良資材を施用する事でCEC(陽イオン交換容量)を高める事が出来る。
◆塩基飽和度:CEC(陽イオン交換容量)に占める塩基類(土壌関係:Ca、Mg、K)の割合
一般の土壌診断では塩基飽和度はカルシウムイオン(Ca²⁺)、マグネシウムイオン(Mg²⁺)、カリウムイオン(K⁺)の割合の合計で示され、水素イオン(H⁺)、ナトリウムイオン(Na⁺)等は除く。
尚、塩基(カルシウムイオン(Ca²⁺)、マグネシウムイオン(Mg²⁺)、カリウムイオン(K⁺))の空席には『水素イオン(H⁺)が着席するという鉄則がある。
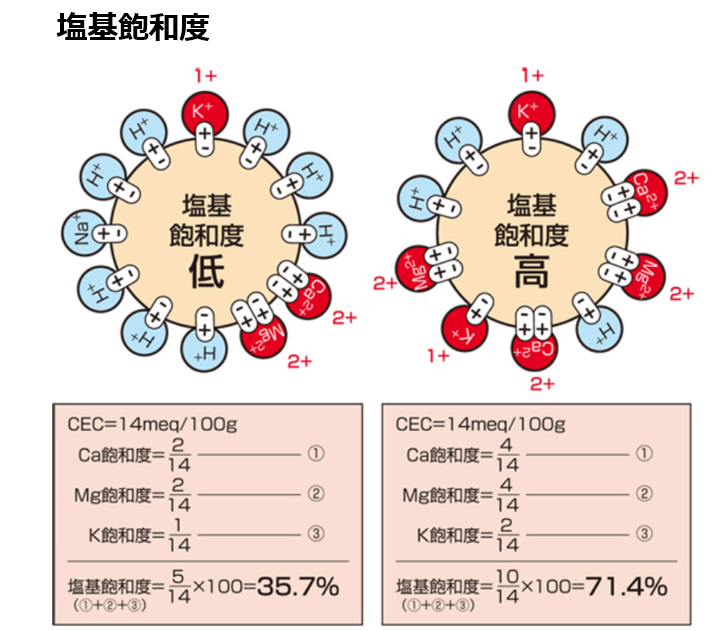
水素イオン(H⁺)は塩基ではない。
水素イオン(H⁺)は酸性の原因を示す物質である。
アレーニウスの酸・塩基の定義より
・酸:水に溶けて水素イオン(H⁺)を生じる物質
⇒塩酸HCl → H⁺+Cl⁻
⇒硫酸H₂SO₄ → 2H⁺+SO₄²⁻
・塩基:水に溶けて水酸化物イオン(OH⁻)を生じる物質
⇒水酸化ナトリウムNaOH → Na⁺+OH⁻
⇒水酸化カルシウムCa(OH)₂ → Ca²⁺+2OH⁻
上記の定義より、土壌コロイドの席に水素イオン(H⁺)が多く着席すると
土は酸性になる。
逆に水素イオン(H⁺)が少ないと、アルカリ性に近づく。
塩基飽和度が100%の場合は、水素イオン(H⁺)はなくなるという事である。
参考に、一般的に適正な塩基飽和度は70~80%とされるが、CEC(陽イオン交換容量)の低い砂土では塩基類の絶対量が不足するので100%を保つように追肥が必要とされる。
◆塩基飽和度とpH(土壌の酸性度)の関係
年間降雨量の多い日本では、酸性を示す土壌が広く分布している。
平成19年10月 農林水産省生産局環境保全型農業対策室
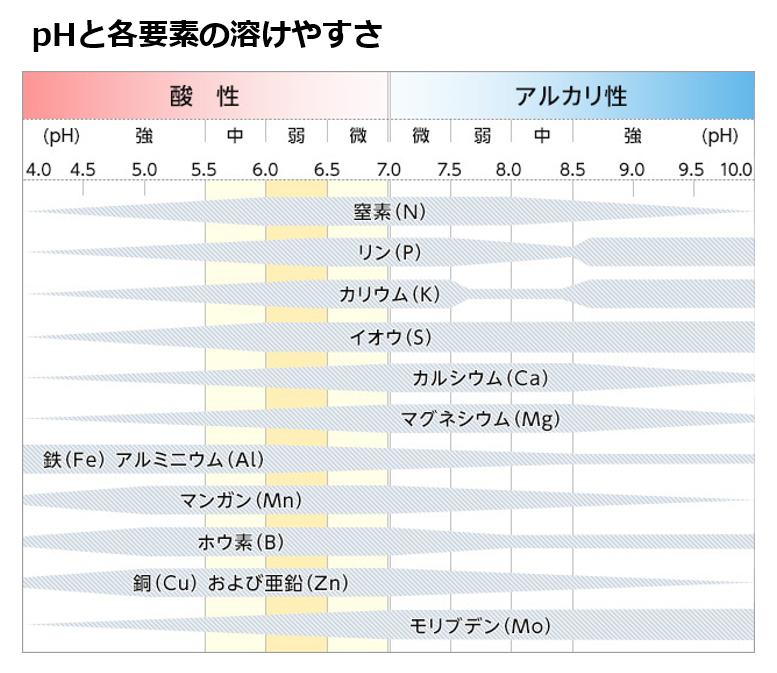
土壌が酸性を示す原因は、土壌溶液中に溶解している
酸性物質(硝酸や硫酸、炭酸のような無機酸と酢酸、酪酸のような有機酸)と、
土壌コロイドに吸着保持されている交換性のアルミニウムイオン(Al³⁺)や交換性水素イオン(H⁺)にある。
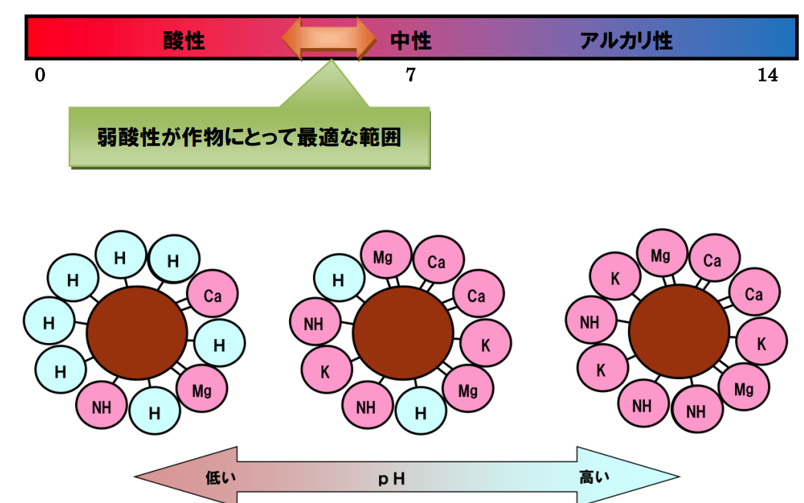
土壌コロイドの負荷電が塩基で飽和されている時は中性の状態であるが、
雨が多かったり生理的酸性肥料を連用したりすると、
塩基が溶脱され、塩基の代わりに水素イオン(H⁺)が土壌コロイドに吸着され酸性になる。(塩基の空席には水素イオンが着席する鉄則による)
http://www.kk-tanbaya.co.jp/cgi-data/hatasaku/img/20110608bunseki.pdf
塩基飽和度とpH(土壌の酸性度)は下図に示すように相関があり、
pHが高いほど塩基飽和度も高い値を示し、
pHが低いほど塩基飽和度も低い値を示す。

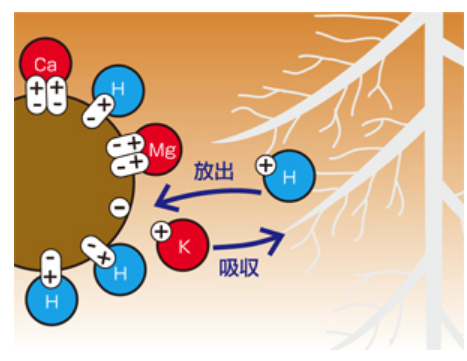
作物は根から養分である陽イオンを吸収する際に、
根から水素イオン(H⁺)を放出する。
その結果、土壌中の水素イオン(H⁺)濃度が増加し、酸性化する。
土壌分析でpHから養分の吸収割合が推定できるのはこのためである。
但し、ハウス土壌などでは、土壌pHが塩基飽和度を反映しない場合もあり、EC(電気伝導度)も測定し、併せて判断する必要がある。
◆必要な窒素の量を探る(EC:Electrical Conductivity)
ECは『電気伝導率』ともいい、水に溶けた塩類の総量を表した数値で、
単位はmC/cm(ミリジーメンスパーセンチメートル)あるいはdS/m(デジジーメンスパーメートル)で表す。
土壌中には様々な物質が存在しており、その中でも作物の栄養分となる物質が塩の形で存在している。
塩とは、酸と塩基の化合物のことをいい、
肥料でいうと硫酸アンモニウムや硝酸アンモニウム、硫酸カルシウム、硫酸マグネシウムなどがある。
塩は、水中でイオンになって電流が流れやすくなる。この電流の流れやすさを示すのがECである。
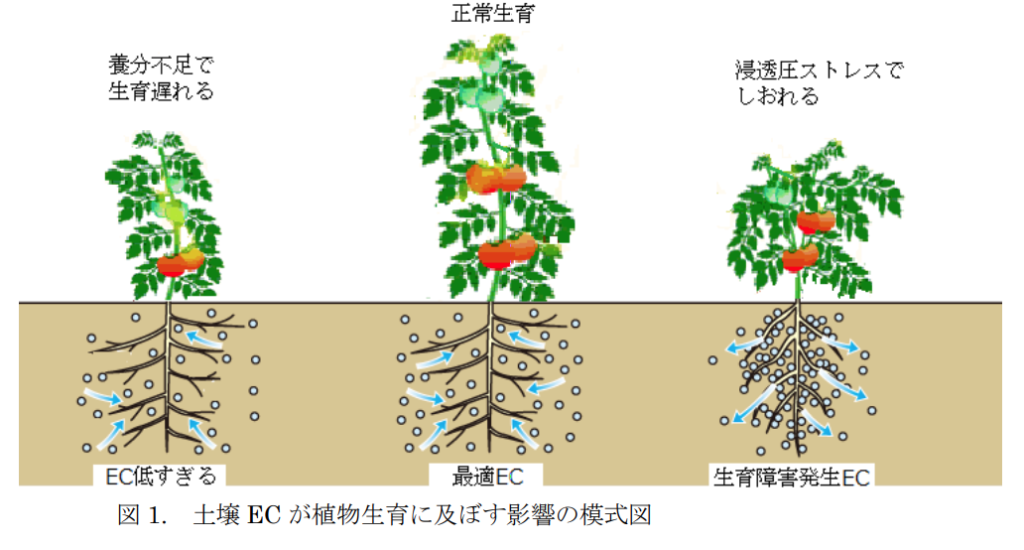
このECの値が大きければ大きいほど、土壌中に塩類、つまり肥料分がたくさんあることを示す。
ECが高いということは、土壌中の塩類濃度が高いことを示し、あまり高いと塩類集積と呼ばれる現象が起こっている可能性がある。
塩類集積により、必要以上に塩類濃度が高くなっていると、肥料焼け(塩類濃度障害)を起こし、根がしおれたり、枯れてしまって、水分を吸収できなくなる。
これは、浸透圧によって根の中の水分が、濃度の濃い土壌中に出ていってしまうために起こる。この問題は、園芸作物に対するもので水稲では起きない。
▽黒ボク土:果菜類0.3~0.8、葉・根菜類0.2~0.6
▽沖積土・洪積土:果菜類0.2~0.7、葉・根菜類0.2~0.5
▽砂質土:果菜類0.1~0.4、葉・根菜類0.1~0.3
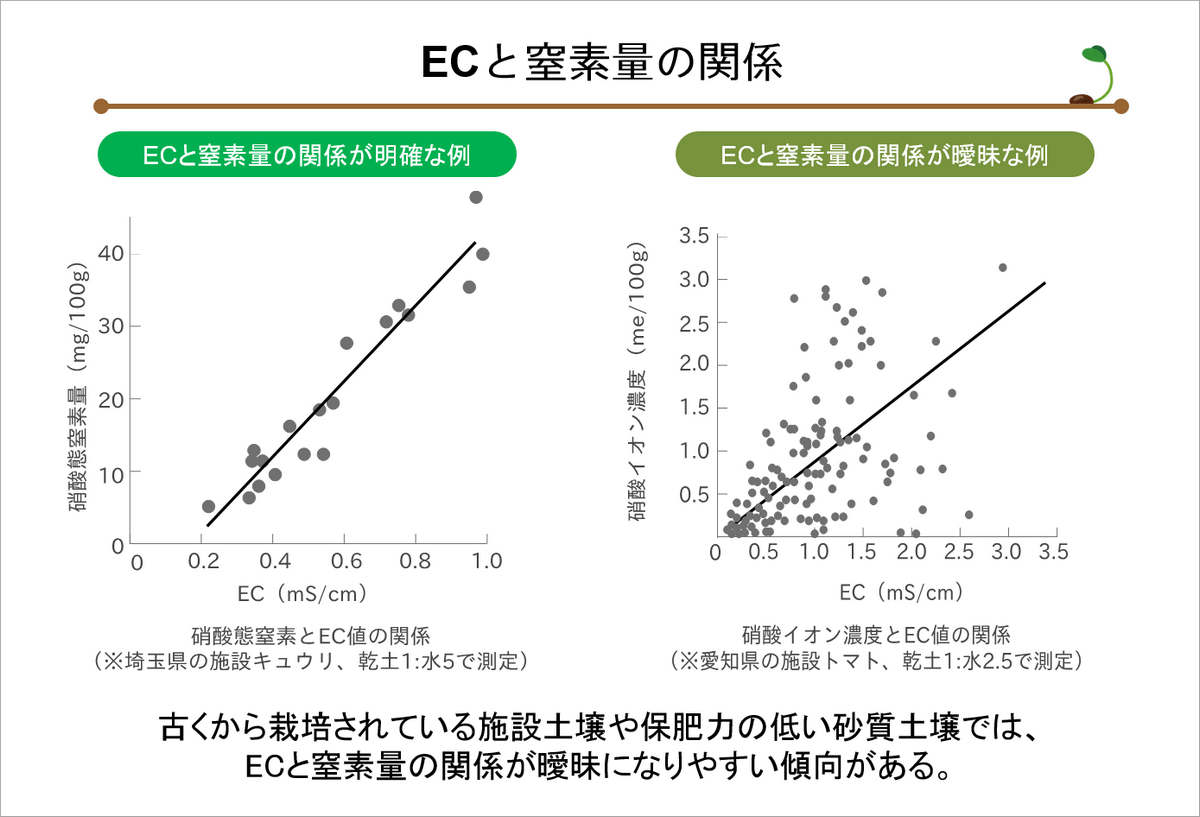
また、ECは、硝酸態窒素との関係が強いため、土壌中に含まれる硝酸態窒素の量を推定するときにも使う。
その推定式は、X=EC(mS/cm)、Y=硝酸態窒素量(mg/100g土)とすると、以下のとおり表せます(藤原、2008)。
▽黒ボク土:Y=38X-10
▽沖積土・洪積土:Y=44X-15
▽砂質土:Y=29X-5
◆測定したpHやECの数値で土の状態を知り、対策を講じる
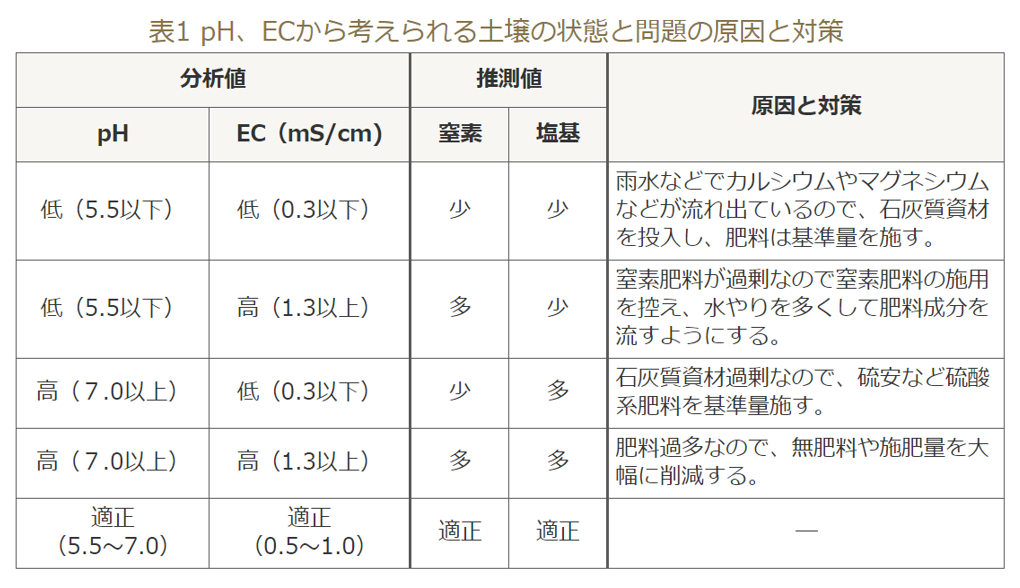
特に日本の土壌ではpHが低い(酸性土)ことが問題になる。
①pHもECも低くなる場合、その原因が雨水によるもので
カルシウム(Ca)とマグネシウム(Mg)等のアルカリ性の養分のほか窒素(N)分も足りなくなっている。
対策として
苦土石灰や貝化石などのアルカリ性の石灰質資材を土に入れて酸化を矯正し、肥料を施す。
②pHが高いあるいは適正でECが低い場合は、
肥料のみ施す。
③pHが低くECが高い場合、
窒素肥料の施し過ぎで窒素分の硝酸イオン(NO³⁻)等が蓄積して酸性になった事も考えられる。
この場合は、窒素肥料の使うのを止める事が対策になる。
尚、窒素肥料のやり過ぎが土の酸性化のもう一つの原因になっている。
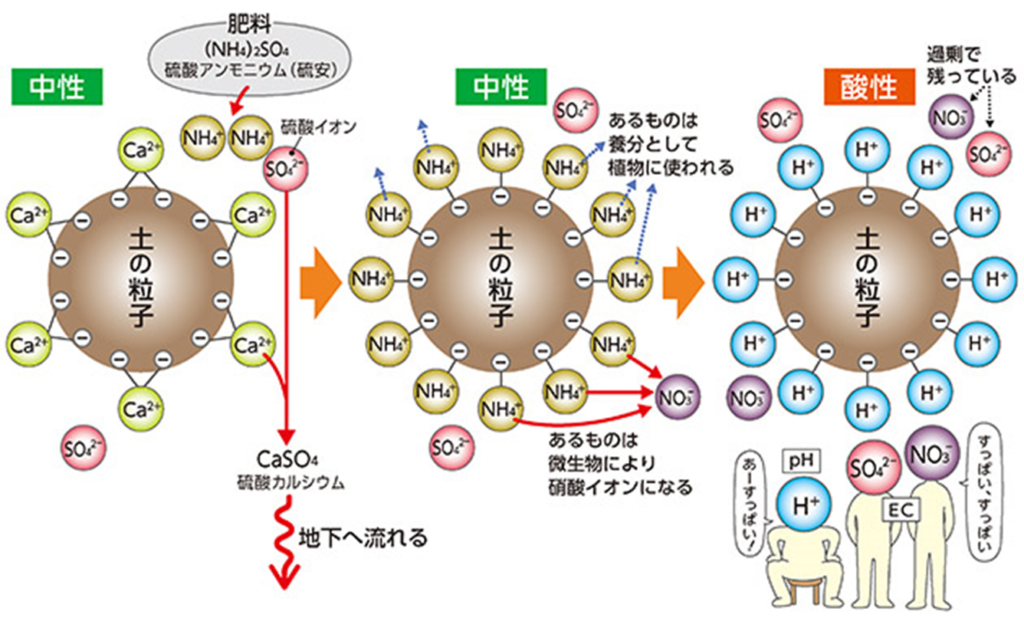
硫酸アンモニウム((NH₄)₂SO₄:硫安)という肥料を施す。
アンモニウムイオン(NH₄⁺)は陽イオンで土の粒子に吸着、つまり椅子に座った状態になる。
アンモニウムイオン(NH₄⁺)は養分として農作物に使われるのに対して、
硫酸イオン(SO₄²⁻)はほとんど使われず土壌に残る
またアンモニウムイオン(NH₄⁺)は、土の中の微生物によって硝酸イオン(NO³⁻)にもなる。
土壌中の硫酸イオン(SO₄²⁻)や硝酸イオン(NO³⁻)は、
土の粒子の表面のカルシウムやマグネシウム等のアルカリ性の陽イオンである塩基類を溶かし、結合(CaSO₄:硫酸カルシウム)して地下に流れていく。
土の粒子表面(土壌コロイド)の塩基類が抜けて空いた椅子には水素イオン(H⁺)が座る。(塩基の空席には水素イオンが着席する鉄則)
土はますます酸化していき、pHは低いものの、過剰な硫酸イオン(SO₄²⁻)や硝酸イオン(NO³⁻)等が残っているのでEC(電気伝導率)は高くなる。
https://sakata-tsushin.com/yomimono/rensai/standard/cat/20190827_007929.html

http://www.kk-tanbaya.co.jp/cgi-data/hatasaku/img/20110608bunseki.pdf
■■参考にチェルノーゼム(黒色土)と『温暖湿潤(多雨)に属する』日本の黒ぼく土(黒色土)の土壌特性の違いを紹介する。■■
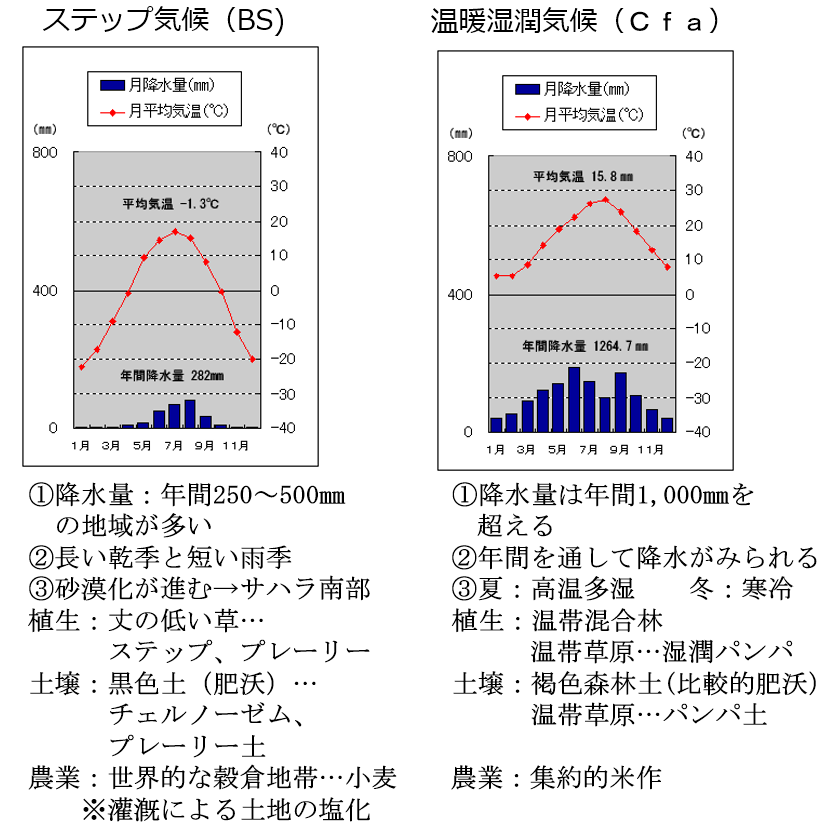
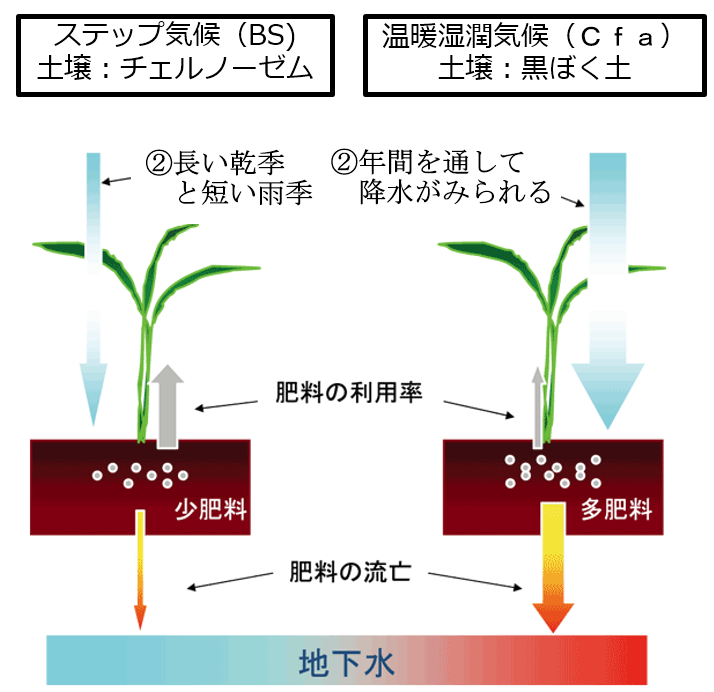
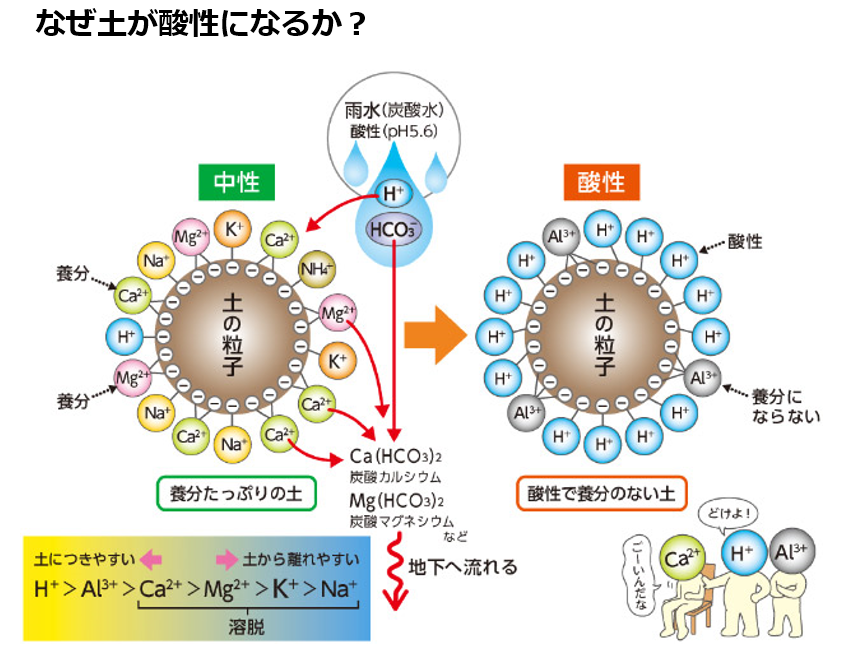
温暖多雨地帯に属する日本は、『多雨』である事が最大の相違点を生み出す。
雨の中に大気中の二酸化炭素が溶け込み、pH5.6前後の酸性の炭酸水になり、土壌に降り注ぐ。
この炭酸水には酸性の水素イオン(H⁺)と炭酸水素イオン(HCO₃⁻)が含まれている。
椅子取りの上手い酸性の水素イオン(H⁺)や栄養の無いアルミニウムイオン(Al³⁺)は、
アルカリ性のカルシウムイオン(Ca²⁺)、マグネシウムイオン(Mg²⁺)を追い出して椅子にどんどん座っていく。(塩基の空席には水素イオンが着席する鉄則)

こうして土壌の塩基分(カルシウム(Ca)、マグネシウム(Mg)などのアルカリ分)が流亡しやすく、土壌栄養素は地下水に流され、その結果、土壌はやせる。
このようにして、雨水は土を酸性にし、同時に養分の少ない状態にしていく。
日本のように、雨の多い国の土が酸性になりやすいのはこの為である。
この場合、pHは低く、ミネラルなどの塩基類も流されやすいのでEC(電気伝導率)も低くなる。
世界一肥沃なチェルノーゼム(黒土)と対照的であり、
同じ黒色土でありながら、その土壌特性は真逆である。
戦後、やせた土壌(黒ぼく土等)に作物の収穫量増大を狙い、大量の窒素、リン酸肥料、カリウムが過剰になるまで投入され続けた。
この窒素肥料のやり過ぎが土の酸性化のもう一つの原因になっている。
硫酸アンモニウム((NH₄)₂SO₄:硫安)という肥料を施す。
アンモニウムイオン(NH₄⁺)は陽イオンで土の粒子に吸着、つまり椅子に座った状態になる。
アンモニウムイオン(NH₄⁺)は養分として農作物に使われるのに対して、
硫酸イオン(SO₄²⁻)はほとんど使われず土壌に残る。
またアンモニウムイオン(NH₄⁺)は、土の中の微生物によって硝酸イオン(NO³⁻)にもなる。
土壌中の硫酸イオン(SO₄²⁻)や硝酸イオン(NO³⁻)は、
土の粒子の表面のカルシウムやマグネシウム等のアルカリ性の陽イオンである塩基類を溶かし、結合(CaSO₄:硫酸カルシウム)して地下に流れていく。
土の粒子表面(土壌コロイド)の塩基類が抜けて空いた椅子には水素イオン(H⁺)が座る。(塩基の空席には水素イオンが着席する鉄則)
土はますます酸化していき、pHは低いものの、過剰な硫酸イオン(SO₄²⁻)や硝酸イオン(NO³⁻)等が残っているのでEC(電気伝導率)は高くなる。